Planétologie/Les atmosphères planétaires
L'atmosphère de chaque planète est quelque peu idiosyncratique mais quelques similitudes peuvent s'observer sur toutes les planètes. Divers paramètres influencent la présence ou le fonctionnement des atmosphères planétaires. Parmi ceux-ci, on trouve notamment la forme de l’orbite céleste, la vitesse de rotation, sans compter la masse et la composition chimique de la planète.

La pression atmosphérique
[modifier | modifier le wikicode]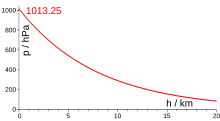
Comme vous le savez peut-être déjà, la pression atmosphérique diminue progressivement avec l'altitude. Alors certes, les différences de température entre couches atmosphériques compliquent quelque peu la donne, ce qui fait que la diminution de pression n'est pas régulière. Mais la diminution de pression avec l'altitude reste un fait valide, quelle que soit l'atmosphère.
L'influence de la pesanteur sur la pression atmosphérique
[modifier | modifier le wikicode]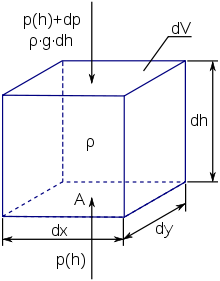
La cause de cette diminution est simplement la force de gravité. Pour comprendre pourquoi, il faut rappeler d'où vient la pression atmosphérique. À une altitude donnée, la pression provient du poids de l'air situé au-dessus. Il va de soi que plus on monte, moins on trouve d'air au-dessus de sa position : moins d'air pesant signifie moins de pression. Pour rendre compte de cela mathématiquement, on peut établir une équation qui donne la différence de pression entre deux points, l'un à une altitude et l'autre à une altitude . En notant la pression , la différence de pression est égale à :
La différence de pression entre deux points A et B est liée au poids de l'air sur la hauteur A-B. Si on prend une petite différence d'altitude, on peut supposer que la pesanteur est constante sur toute l'épaisseur de l'atmosphère. L'équation différentielle précédente s'écrit alors comme suit, avec la densité de l'air et l'accélération de la pesanteur :
On divise l'équation précédente par h :
On peut alors passer à la limite, ce qui donne :
La relation entre pression atmosphérique et densité de l'air
[modifier | modifier le wikicode]Cette équation lie la densité de l'air à la variation verticale de pression. On ne peut la résoudre sans faire d'hypothèses sur l'évolution de la densité avec l'altitude. On peut évidemment penser que la densité de l'air diminue avec l'altitude, ce qui est intuitif. Et c'est effectivement ce qu'on observe dans les atmosphères planétaires. Mais il reste à quantifier le tout convenablement.
Pour commencer, nous allons devoir exprimer la densité, et plus précisément la masse volumique, en fonction de la densité de particules. Rappelons que la densité massique, à savoir la masse volumique, est la quantité de masse présente dans une unité de volume. Par contre, la densité de particule est le nombre de particules par unité de volume. Dans ce qui va suivre, le nombre de particules sera mesuré en moles, l'unité de mesure utilisée en chimie pour compter les particules. Les deux quantités sont reliées par l'équation suivante :
- , avec p la densité massique, la masse d'une mole de gaz (la masse molaire du gaz) et la quantité de moles dans le volume V.
Multiplions maintenant l'équation précédente par g, l'accélération de la pesanteur :
Pour poursuivre, nous allons faire une hypothèse : l'atmosphère est un gaz parfait. Cette approximation est clairement valide dans les atmosphères planétaires que nous allons étudier, au moins dans la troposphère. Sous cette condition, la loi des gaz parfait peut se réécrire comme suit :
En combinant les deux équations précédentes, on trouve :
On peut maintenant introduire cette équation dans l'équation différentielle , ce qui donne :
Et que l'on peut reformuler sous cette forme :
L'exemple d'une atmosphère isotherme
[modifier | modifier le wikicode]Maintenant, nous allons supposer que la température reste la même sur toute la hauteur de l'atmosphère. Dans ce cas, le terme est constant et indépendant de la pression. Pour des raisons que nous expliquerons plus tard, nous allons noter H l'inverse de ce terme. L'équation précédente devient donc :
On reformule :
Prenons l'intégrale :
Le calcul de l'intégrale donne :
En posant , l'équation précédente devient celle ci-dessous. Elle nous dit que la constante k n'est autre que le logarithme de la pression au sol (altitude 0).
En combinant les deux équations précédentes, on a :
En prenant l'exponentielle, on a :
Cette équation nous dit que la pression diminue exponentiellement avec l'altitude. Elle permet aussi de donner une interprétation simple à la constante H : c'est l'altitude qu'il faut monter pour que la pression soit divisée par e (la constante des logarithmes népériens). La constante H est appelée l'échelle d'altitude (scale height).
Rappelons que l'équation précédente ne vaut que si la température est constante sur tout le profil vertical de l'atmosphère. Dans la section suivante, nous allons relaxer cette hypothèse, en étudiant comment varie la température avec l'altitude, dans la troposphère.

L'exemple d'une atmosphère avec un gradient vertical de température linéaire
[modifier | modifier le wikicode]Une hypothèse plus réaliste, du moins dans la troposphère, est de supposer que la température est une fonction affine de l'altitude. Nous justifierons cette hypothèse dans le paragraphe suivant, qui porte sur l'évolution de la température dans la troposphère.
Partons de l'équation démontrée précédemment :
Pour simplifier les calculs, nous allons poser la constante , qui regroupe tous les termes indépendants de l'altitude. L'équation précédente devient alors :
L'hypothèse nous dit que la température est une fonction de l’altitude z, de la forme . En faisant le remplacement, nous avons :
Prenons l’intégrale :
Le calcul de l'intégrale donne :
On développe l'expression précédente :
Pour , l'équation précédente devient :
En combinant les deux équations précédentes, on a :
En simplifiant et en factorisant , on trouve :
On utilise la formule :
En prenant l'exponentielle, on obtient :
La température des atmosphères planétaires
[modifier | modifier le wikicode]On vient de voir dans le chapitre précédent que l'on peut calculer la température de surface d'une planète, en tenant compte ou non de l'effet de serre. Cependant, la température de l'atmosphère varie avec l'altitude, de même que sa pression. Ces variations sont la résultante de deux phénomènes distincts : le rayonnement solaire et la pression atmosphérique. Dans cette section, nous allons voir comment ces deux phénomènes influencent la température de l'atmosphère, et comment cette température évolue avec l'altitude.
La structure thermique des atmosphères planétaires
[modifier | modifier le wikicode]La pression atmosphérique baisse naturellement avec l'altitude, ce qui retentit sur la température (via la loi des gaz parfaits). Plus l'altitude, et donc la pression atmosphérique, baissent, plus la température fait de même. L'effet du rayonnement solaire va dans le sens opposé : il fait augmenter la température avec l'altitude. En effet, le sommet de l'atmosphère étant plus irradié, car l’atmosphère absorbe du rayonnement sur toute son épaisseur. En général, ces deux phénomènes structurent l'atmosphère planétaire en deux couches : une troposphère où la température diminue avec l'altitude, et une thermosphère où elle augmente. Dans la troposphère, le refroidissement par baisse de pression l'emporte sur l'effet du rayonnement, d'où la baisse de température avec l'altitude. C’est l'inverse dans la thermosphère, chauffée par le Soleil, où le rayonnement l'emporte, ce qui explique pourquoi la température augmente avec l'altitude.
Parfois, des couches supplémentaires peuvent se rajouter, en raison de phénomènes physiques particuliers, liés à la composition chimique exacte de l'atmosphère, qui varie avec l'altitude. C'est le cas sur la Terre, où on observe grossièrement quatre couches distinctes, qu'on ne retrouve pas forcément sur les autres planètes.
- La couche d'atmosphère proche du sol, où les nuages et les phénomènes météorologiques se forment, est appelée la troposphère. C'est une couche où la température baisse avec l'altitude.
- Elle est suivie par une zone où la température augmente avec l'altitude : la stratosphère.
- Au-dessus de la stratosphère, les températures diminuent dans la mésosphère.
- Au-delà, on trouve une couche atmosphérique où la densité et la pression chutent fortement alors que la température augmente de plus belle : cette thermosphère est la lisière de l'atmosphère, la fin de celle-ci.
L'existence de la stratosphère terrestre est liée à la couche d'ozone, une couche riche en ozone située au sommet de la troposphère. Cette couche d'ozone absorbe une bonne partie du rayonnement ultraviolet solaire. La couche d'ozone protège la surface des ultraviolets et on peut dire de manière imagée que la Terre est protégée par une couche d'écran total gazeux qui se trouve à la base de la stratosphère. En absorbant les ultraviolets, la couche d'ozone se réchauffe. Ce faisant, elle réchauffe l'air environnant et chauffe la stratosphère par la base. C’est pour cela que la stratosphère existe et que la température augmente avec l'altitude dans celle-ci. On observerait une structuration en deux couches s'il n'y avait pas la stratosphère pour couper la base de l'atmosphère en deux (la troposphère proprement dit et la mésosphère).

Les autres planètes du système solaire ont une structure verticale moins complexe, avec seulement deux à trois couches, guère plus. Par exemple, Vénus, Uranus et Jupiter ont une structure en trois couches. Sur Jupiter, une couche de température uniforme vient s'intercaler entre la thermosphère et la troposphère. Vénus et Mars ont une structure verticale similaire à celle de la Terre, sauf que la stratosphère n'existe pas, car il n'y a pas d'ozone ou de gaz équivalent pour absorber le rayonnement solaire.

La température dans la troposphère
[modifier | modifier le wikicode]Nous allons maintenant étudier la variation de la température dans la troposphère. Comme on le sait déjà, la température baisse avec l'altitude, du moins dans la troposphère. Cette diminution est essentiellement liée à la baisse de pression avec l'altitude. L'existence d'une stratosphère, ou des autres couches, est liée à l'absorption du rayonnement solaire par l'atmosphère, à la base de la stratosphère. Dans ce qui va suivre, nous allons nous concentrer sur l'évolution de la température dans la troposphère. Nous allons démontrer que la température troposphérique diminue linéairement avec l'altitude.
Pour la démonstration, nous allons utiliser l'enthalpie de l'air, à savoir la somme de l'énergie interne de l'air et du travail nécessaire pour lui faire atteindre la pression P. Par définition, celle-ci vaut . La thermodynamique nous donne la valeur de la variation d'enthalpie, ce qui donne :
Nous allons ensuite supposer que l'air, quand il monte ou descend, n'échange pas de chaleur avec l'air environnant. Dit autrement, les variations de température proviennent de variations de pression, mais pas de gains ou de pertes de chaleur. Cette hypothèse tient bien dans la troposphère, mais pas dans les autres couches, où l'absorption du rayonnement solaire chauffe l'air quand il monte. Vu qu'il n'y a pas d'échange de chaleur, l'entropie ne varie pas, ce qui donne :
Divisons par :
Or, nous avons démontré plus haut que . Le remplacement donne :
Le produit (volume par densité) n'est autre que la masse du gaz :
L'équation précédente a une interprétation simple : sans échange de chaleur, l’enthalpie de l'air varie avec l'altitude en raison de la gravité. Une parcelle d'air possède une énergie potentielle de pesanteur, dont les variations se répercutent sur son énergie interne et donc son enthalpie. En soi, ce n'est pas étonnant : si on omet les échanges de chaleur, seul un travail mécanique peut modifier l’enthalpie de l'air. Et dans le cas qui nous intéresse, ce travail mécanique ne peut venir que de la gravité.
Une autre équation de la thermodynamique nous dit que , avec la capacité calorifique à pression constante. On a donc :
Divisons par :
Maintenant, on peut en déduire la température qu'il fait à l'altitude z. Pour cela, prenons l'intégrale suivante :
Le calcul de l'intégrale donne :
Ce qui se reformule comme suit :
On voit que la température est une fonction affine de l'altitude et qu'elle décroit avec l'altitude. Le coefficient de proportionnalité est appelé le gradient adiabatique sec.
La chimie des atmosphères planétaires
[modifier | modifier le wikicode]L'étude de la composition chimique des atmosphères est assez compliquée. Divers indices permettent aux astronomes de déduire la composition atmosphérique avec une assez bonne fiabilité. La première, et de loin la plus efficace, est d'envoyer des sondes sur place. Les sondes peuvent faire des prélèvements lors de leur traversée de l'atmosphère et faire des analyses. Mais toutes les planètes n'ont pas reçu la visite d'une sonde, ce qui fait que cette méthode n'est pas applicable partout. Une autre possibilité est d'étudier la lumière renvoyée par l'atmosphère quand elle est éclairée par le Soleil. En comparant le spectre de la lumière solaire avec le spectre de la lumière renvoyée, on en déduit la composition chimique atmosphérique. On peut étudier ce spectre pour diverses bandes de fréquences, en regardant la surface aux infrarouges, aux ultraviolets, dans la lumière visible, etc.
La composition chimique des atmosphères planétaires
[modifier | modifier le wikicode]L'atmosphère des planètes est un mélange de plusieurs gaz, de plusieurs molécules bien distinctes. Et toutes les planètes n'ont pas des atmosphères de même composition chimique. Les planètes géantes ont des atmosphères riches en Hydrogène et en Hélium, alors que les planètes telluriques ont des atmosphères riches en carbone, oxygène et azote. Globalement, les atmosphères des géantes sont riches en éléments volatils, légers, alors que les atmosphères des planètes telluriques possèdent des éléments plus lourds. La raison à cela est que les planètes géantes ont une gravité bien plus importante que les planètes telluriques. Les éléments légers s'enfuient de l'atmosphère des planètes telluriques qui n'ont pas la gravité suffisante. Alors que les planètes géantes ont une gravité suffisante pour garder les éléments légers dans leur atmosphère.
| Éléments chimiques et/ou gaz dominants | Molécules dominantes | Caractère oxydant ou réducteur | |
|---|---|---|---|
| Planètes géantes | Hydrogène, Hélium | Eau, méthane, ammoniac | Réducteur |
| Satellites des planètes géantes | Carbone, oxygène et azote | Diazote, méthane | |
| Planètes telluriques | Diazote, dioxyde de carbone. | Oxydant |
La composition chimique des planètes gazeuses
[modifier | modifier le wikicode]Les planètes géantes sont essentiellement composées d'Hydrogène et d'Hélium, les deux éléments les plus courants dans l'univers. On trouve aussi du méthane, de l'ammoniac et de la vapeur d'eau dans leurs atmosphères. Au vu d'une telle composition chimique, l'atmosphère est très réductrice. L'hélium est presque inerte chimiquement, à savoir qu'il a peu de réactions chimiques comparé à l'hydrogène. La chimie des atmosphères des planètes géantes est donc dominée par la chimie de l'hydrogène. L'hydrogène y réagit avec le carbone, l'oxygène, l'azote et le phosphore.
La composition chimique des atmosphères des planètes géantes varie entre l'intérieur et l'extérieur. L'extérieur est soumis au rayonnement solaire, alors que l'intérieur est protégé du rayonnement solaire absorbé par les couches sus-jacentes. L'intérieur est donc gouverné par une chimie d'équilibre. Les réactions donnent du méthane, de l'eau, de l'ammoniac et du , les quatre molécules qui dominent les atmosphères des planètes géantes. La composition chimique est cependant altérée au sommet de l'atmosphère, en raison du rayonnement solaire. Le rayonnement casse les molécules et leur permet de se recombiner, donnant de nombreux composés organiques complexes, dont des hydrocarbures. Mais ces molécules complexes sont détruites par diverses réactions chimiques, surtout dans la couche intérieure de l'atmosphère. Ce qui fait qu'elles ne s'accumulent pas et que leur concentration restent approximativement constantes.
La composition chimique des corps telluriques
[modifier | modifier le wikicode]Pour ce qui est des corps telluriques, leur atmosphère est différente de celle des géantes. Elles sont systématiquement pauvres en Hydrogène et en Hélium, ce qui les distingue des planètes géantes. Par contre, elle sont riches en carbone, oxygène, azote, phosphore, soufre, et autres. Les trois éléments chimiques principaux sont clairement le carbone, l'azote et l'oxygène, les autres éléments étant moins importants. Ces éléments se combinent pour former des molécules différentes suivant la planète ou le corps tellurique considéré. Globalement, on peut séparer les atmosphères des planètes telluriques de celles des satellites des planètes géantes. La séparation est plus clairement entre les corps telluriques du système solaire interne et ceux du système solaire externe.
La plupart des satellites des planètes géantes, ainsi que Pluton, ont quant à eux une atmosphère riche en diazote, méthane et dioxyde de soufre. L'environnement est, ici aussi, fortement réducteur.
Les planètes telluriques ont des atmosphères qui se ressemblent, avec cependant quelques spécificités pour la Terre. Leur air est composé essentiellement de diazote et de dioxyde de carbone, avec d'autres éléments secondaires. L'ensemble donne une atmosphère oxydante ou neutre, mais souvent oxydante. Pour ce qui est des différences, c'est surtout la Terre qui se distingue de Vénus et Mars, par la présence d'oxygène et d'eau. La Terre a une atmosphère très riche en oxygène, alors que Venus et Mars n'en ont pas et n'ont que du CO₂ et du N₂ dans leur atmosphère. De plus, Venus et Mars sont assez pauvres en eau, contrairement à la Terre. Si la présence d'oxygène s'explique par la photosynthèse, elle-même causée par la présence de la vie et donc de l'eau.

Pour comprendre pourquoi de telles différences, il nous faut étudier comment les atmosphères planétaires se sont formées et ont évolué, ce qui nous amène à la section suivante. Pour donner quelques explications rapides, avant de passer aux explications poussées, on peut dire que les géantes ont une atmosphère primordiale, alors que les planètes telluriques ont des atmosphères évoluées. L'atmosphère des planètes géantes a une composition chimique qui correspond assez bien à la nébuleuse primordiale. L'atmosphère s'est mise en place en même temps que la planète s'est formées et a peu évolué depuis. Mais pour les planètes telluriques, il ne reste plus grand-chose de l'atmosphère originelle, qui a évolué en raison de divers mécanismes. Nous verrons tout cela plus en détail à la fin du chapitre.
La photochimie des atmosphères planétaires
[modifier | modifier le wikicode]L'atmosphère est irradiée par le rayonnement solaire et ce n'est pas sans conséquences. Les molécules/atomes d'air peuvent absorber les photons du rayonnement solaire, ce qui leur fait gagner de l'énergie. Pour un rayonnement peu énergétique, la molécule ou l'atome finissent soit par renvoyer la lumière absorbée, soit par la transformer en chaleur. Pour un rayonnement plus énergétique, les molécules peuvent se briser en morceaux, donnant des molécules plus simples ou des atomes individuels. Et si le rayonnement est encore plus énergétique, il peut ioniser les atomes, à savoir leur arracher des électrons et laisser un atome chargé positivement derrière lui. Trois processus sont donc possibles : l'absorption, la photolyse (molécules brisées) et la photo-ionisation (atomes ionisés). Dans ce qui suit, nous allons surtout nous intéresser à la photolyse et la photo-ionisation, vu que ce sont les seuls processus capables de changer directement la composition chimique de l'atmosphère. L'absorption n'a qu'un effet indirect, lié à la température, aussi nous le mettons de côté pour le moment.
Vu que le rayonnement est progressivement absorbé par l'atmosphère, le rayonnement est plus intense au sommet de l'atmosphère et diminue progressivement quand on se rapproche du sol. L'atmosphère a donc une composition ionique et moléculaire différente selon l'altitude. À basse altitude, les processus photochimiques sont inexistants, car il n'y a pas assez de rayonnement. Les molécules se forment en plus grand nombre et les couches basses ont une richesse chimique assez importante. À plus haute altitude, la photolyse fait son effet et brise les molécules fragiles. Enfin, le sommet de l'atmosphère est dominé par les processus de photo-ionisation.
La photo-ionisation et l'ionosphère
[modifier | modifier le wikicode]Étudions maintenant la photo-ionisation. À cause d'elle, le sommet de l'atmosphère est composé d'une couche de gaz partiellement ionisée, voir totalement ionisée : l'ionosphère. Dans cette couche, les ionisations sont très fréquentes et se produisent rapidement. Les électrons libérés lors de l'ionisation sont appelés des photoélectrons. Mais il se produit aussi des réactions inverses, où un ion se recombine avec un électron libre pour donner l'atome initial. Les deux types de réactions s'équilibrent, ce qui fait que la concentration en ion est plus ou moins constante à une altitude donnée. L'ionosphère est donc un mélange d'ions, d'électrons libres et d'atomes non-ionisés en quantités variables. Plus on remonte vers le sommet de l'atmosphère, plus la concentration en ions et électrons libres est importante et plus les atomes non-ionisés se font rares.

Sur Terre, l'ionosphère est structurée en plusieurs couches, aux concentrations en ions/électrons libres différentes. Les couches sont nommées, par altitude croissante, couches D, E, F1 et F2. Elles existent parce que les réactions chimiques d'ionisation/recombinaison ne sont pas les mêmes suivant l'altitude. L'intensité du rayonnement et la densité des couches font que certaines réactions sont plus fréquentes à une altitude donnée. Notons que les couches D et F1 n'existe que sur la face jour de la Terre, celle éclairée par le Soleil. Rien d'étonnant, la photo-ionisation ne se produisant que si le rayonnement solaire est assez fort. Techniquement, la photo-ionisation ne se produit que le jour, la photo-ionisation de nuit étant marginale. Mais les ions prennent du temps à se recombiner avec les électrons libres, ce qui fait que l'ionosphère continue à exister durant la nuit. L'ionosphère est donc moins chargée du côté nuit que du côté jour.

Dans l'atmosphère des planètes gazeuses, la photo-ionisation agit sur l'hydrogène et l'hélium, donnant naissance à des ions hydrogène, dihydrogène et hélium. Ces ions , et peuvent échanger des électrons avec d'autres molécules de et . Et même si le plus souvent, cela ne fait que passer une charge d'un ion à un autre, il arrive que cela donne naissance à des molécules de . Ces molécules de , , et se recombinent avec des électrons pour redonner un atome ou une molécule non-chargé. Et ces réactions de recombinaison sont le plus souvent assez rapides.
Notons cependant que la recombinaison de l'ion est très lente et que cet ion est le plus souvent éliminé par une réaction avec de l'hydrogène moléculaire , que voici : . Ce qu'il faut en retenir est que l'ion hydrogène est éliminé plus ou moins rapidement, suivant la teneur en de l'atmosphère. Une teneur forte en dans l'atmosphère fait que l'ion n'a pas la possibilité de s'accumuler ou de réagir. À l'inverse, si l'atmosphère est pauvre en , alors l'ion est éliminé lentement et s'accumule dans l'ionosphère et les basses couches. Il réagit alors avec d'autres molécules et y forme des molécules organiques plus ou moins complexes, comme nous allons le voir dans ce qui suit.
La photodissociation dans les atmosphères planétaires
[modifier | modifier le wikicode]Passons maintenant à la photodissociation, aussi appelée photolyse. Suivant la composition chimique de la planète, l'effet de la photolyse n'est pas exactement le même. Par exemple, la photodissociation du méthane ne donne pas les mêmes composés que la photodissociation de l'oxygène. Dans les grandes lignes, on peut classer les atmosphères planétaires en deux grands types : celles qui sont réductrices et celles qui sont oxydantes. Pour simplifier, les premières sont pauvres en oxygènes, alors que les secondes sont riches en oxygène. Les atmosphères réductrices sont surtout composées de méthane et de nitrates, alors que les atmosphères oxydantes sont riches en CO₂, H₂O, O₂, SO₂, etc.
Commençons par aborder les atmosphères oxydantes. Celles-ci sont surtout riches en dioxyde de carbone et en diazote, éventuellement en oxygène et en eau. Le diazote étant une molécule assez solide, il n'est pas facilement brisé par le rayonnement solaire. La photochimie des atmosphères oxydantes est donc dominée par la photolyse du dioxyde de carbone, à savoir la réaction suivante :
La réaction inverse est très lente et ne permet pas de reconstituer des stocks de dioxyde de carbone importants. Ce faisant, on peut considérer que le dioxyde de carbone est progressivement dégradé par le rayonnement solaire. Un autre problème est que l'oxygène libéré réagit vite pour former de l'oxygène moléculaire , ce qui empéche la réaction inverse de se produire. En tenant compte de cela, la réaction précédente s'écrit comme suit :
L'équation précédente dit que l'on devrait trouver deux fois plus de que d' dans l'atmosphère de la Terre, de Vénus et de Mars, soit un ratio de 2:1. En réalité, ce n'est pas le cas, ni pour Vénus, ni pour Mars, ni pour la Terre. Sur Vénus, le ratio est de plusieurs ordres de grandeurs plus élevé. Sur Mars, il est de 0.5, soit 4 fois moins que la prédiction théorique. La raison est que et sont impliqués dans des réactions chimiques, qui éliminent ou de l'atmosphère. Sur Vénus, l'oxygène est consommé lors de la formation d'acide sulfurique. Sur Mars, le est reconstitué par des réactions chimiques impliquant de la vapeur d'eau. Nous verrons cela plus en détail dans les chapitres sur Mars et Vénus.
Passons maintenant aux atmosphères réductrices.
- Les atmosphères de Jupiter et Saturne sont surtout composées de dihydrogène et d'hélium, deux gaz inertes chimiquement. Mais la présence de traces de méthane et de nitrates les classe dans la catégorie des atmosphères réductrices.
Dans les atmosphères réductrices, la photodissociation permet la formation de méthyl, de molécule de CH, d'éthylène et de diacétylène. Tout démarre avec la photodissociation du méthane, qui peut se produire selon les réactions suivantes :
Les réactions les plus importantes dans les atmosphères planétaires sont supposées être les deux dernières. En clair, le méthane est photodissocié pour donner soit un radical méthyl , soit un radical , soit un radical . Notons que les trois radicaux peuvent se convertir l'un en l'autre grâce aux réactions suivantes :
De là, de nombreuses molécules peuvent se former. Voici les réactions impliquant le et les produits de réaction :
| Ethane | |
|---|---|
| Éthylène | |
| Propane | |
| Cyanure d'hydrogène |
La plus importante est la réaction de formation d’Éthylène, qui consomme à la fois le radical méthyl et le radical . Une fois de l’éthylène formé, deux voies sont possibles :
- Une voie qui donne du méthyl-acétylène, puis du ou du .
- Une voie qui donne de l'acétylène, puis du di-acétylène, du et du du .
Dans la première voie, l'éthylène se combine avec une molécule de , et donne du méthyl-acétylène , qui est soit photodissociée en , ou qui est associée avec de l'hydrogène pour donner du . Dans la seconde voie, l’éthylène est photo-dissocié pour donner de l'acétylène , qui peut lui-même se photo-dissocier en ou réagir avec ce dernier pour donner du di-acétylène .
Outre ces deux voies, de nombreuses autres réactions chimiques sont possibles. Par exemple, de l'éthane peut se former par recombinaison de méthyl ou d'éthylène, ou via des réactions autres. Et de nombreuses autres réactions peuvent se produire et former du propane, du méthylacétylène, du benzène, et bien d'autres molécules. Au final, les réactions de photodissociation du méthane donnent naissance à des hydrocarbures. Si on omet les réactions liées au , la chimie des atmosphères réductrices est assez bien résumée, pour les réactions principales, par le schéma suivant.
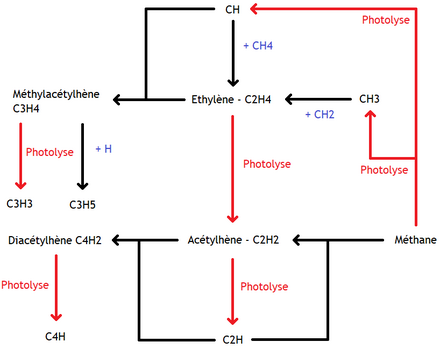
Les planètes telluriques ont une atmosphère oxydante, riches en composés oxygénés, ainsi qu'en diazote. La photodissociation du diazote donne des atomes d'azote, qui peuvent réagir avec les hydrocarbures environnants. Les réactions chimiques qui s’ensuivent, ainsi que les nombreuses photodissociations possibles, entraînent la formation de nombreuses molécules azotées : cyanogène, di-cyanogène, HCN, acétonitrile, cyanoacétylène, etc. Mais ce qui va surtout nous intéresser est la photodissociation des composés oxygènes, dominants sur les planètes telluriques. Et leur photochimie dépend de la molécule majoritaire. Les atmosphères de Mars et Vénus sont riches en dioxyde de carbone, alors que la Terre est riche en oxygène et en eau. On pourrait aussi rajouter le dioxyde de soufre, présent dans l'atmosphère de Vénus et du satellite Io, un satellite de Jupiter.
Sur Mars et Vénus, la photodissociation du dioxyde de carbone CO₂ devrait donner du monoxyde de carbone CO et de l'oxygène (). La réaction inverse () est beaucoup trop lente pour avoir le moindre effet notable. On devrait s'attendre à ce que les atmosphères telluriques s'appauvrissent en dioxyde ce carbone et s'enrichissent en monoxyde ce carbone. Mais diverses réactions vont régénérer le dioxyde de carbone, notamment la réaction . Ce faisant, la concentration en CO₂ reste assez stable et l'atmosphère ne s'enrichit pas en CO ni en oxygène. Ces réactions impliquent toutes de composés oxygénés, notamment de l'OH ou de l'eau, qui sont générés par la photochimie de l'oxygène. Pour simplifier, la photodissociation du dioxygène O₂ donne des atomes d'oxygène libre. Ces derniers peuvent réagir avec de nombreuses autres molécules, pour donner de l'eau, la molécule OH, du SO₂, et bien d'autres encore. Ce sont ces composés qui se combinent avec le CO pour régénérer le CO₂ initial.
Le cycle de l'ozone dans les atmosphères planétaires
[modifier | modifier le wikicode]Dans ce qui va suivre, nous allons étudier la photochimie de l'oxygène pour la Terre, qui est un peu particulière, mais pas si mal pour représenter la photochimie des autres atmosphères. La photochimie de l'oxygène est aussi connue sous le nom de cycle de l'ozone. L'ozone est une molécule composée de trois atomes d'oxygène, de formule . Elle est fabriquée à partir de la photolyse de la molécule de dioxygène. Les rayonnements ultraviolets peuvent en effet briser le dioxygène en atomes d'oxygène individuels, qui se recombinent pour redonner de l'oxygène ou pour former de l'ozone. La photodissociation est décrite par l'équation suivante :
Les réactions de recombinaison possibles sont les trois suivantes. La première est une réaction qui implique uniquement l'oxygène, alors que les deux suivantes sont des réactions catalysées. Pour rappel, la catalyse correspond au cas où une réaction est accélérée par la présence d'une molécule (le catalyseur) qui facilite la réaction mais n'est pas consommée par la réaction chimique. La première réaction est effroyablement lente dans les conditions de pression et de température sur Terre. Les deux réactions suivantes sont beaucoup plus rapides, du fait de la catalyse, ce qui fait qu'elles sont responsables de la chimie de l'atmosphère. On voit que grâce à la troisième réaction, de l'ozone se forme dans l'atmosphère terrestre.
- , la réaction inverse de la photolyse.
- , où X est une autre molécule.
- , qui donne de l'ozone.
L'ozone est détruit par plusieurs mécanismes. En premier lieu, il peut être détruit par combinaison avec un atome d'Oxygène. Il peut aussi subir une photodissociation. Les deux réactions sont les suivantes :
L’ensemble de ces réactions impliquant l'ozone s'appelle le cycle de Chapman. De nombreuses autres réactions chimiques impliquent l'ozone mais ne font pas partie du cycle de Chapman proprement dit. Elles peuvent mener à la destruction d'ozone, mais elles sont assez nombreuses et impliquent des molécules assez rares dans la nature, ce qui fait que nous n'en parlerons pas ici. Quoi qu'il en soit, de nombreux catalyseurs accélèrent la destruction de l'ozone : hydrogène libre, oxydes nitriques (NOx), halogènes et autres. La plupart étaient produits par l'industrie, mais de nombreuses régulations environnementales ont réduit l'émission de ces catalyseurs, afin de préserver la couche d'ozone.
La fabrication d'ozone est maximale au sommet de la stratosphère, au niveau de ce qu'on appelle la couche d'ozone. Celle-ci est une couche de l'atmosphère terrestre riche en ozone, située à la base de la stratosphère. L'ozone ayant une bonne capacité d'absorption du rayonnement solaire, la stratosphère se réchauffe par la base. Cela fait que la stratosphère est chauffée par le bas, ce qui explique pourquoi la température augmente avec l’altitude dans la stratosphère. Précisons que la couche d'ozone est très développée sur Terre, mais que les autres planètes telluriques ont aussi une couche d'ozone, bien que moins bien développée. La plus faible teneur en oxygène des atmosphères de Mars, Venus et des satellites telluriques, fait que leurs couches d'ozone sont plus minces et plus petites. Mais les réactions vues plus haut sont quand même valables pour toutes les atmosphères oxydantes. Sur Mars et Vénus, l'oxygène impliqué dans le cycle de l'ozone est fabriqué lors de la photodissociation du CO₂. Sur Terre, il est fabriqué par la photosynthèse.

L’évolution des atmosphères : composition chimique et conditions pour l'existence/absence d'une atmosphère
[modifier | modifier le wikicode]Mises à part Mercure et les planètes naines, les planètes telluriques ont une atmosphère, de même que toutes les planètes gazeuses. Il est intéressant d'étudier les conditions qui permettent à une planète de conserver son atmosphère. Divers phénomènes entrent en jeu : gravitation universelle, présence d'un champ magnétique, vent solaire intense, etc. La présence ou l'absence d’une atmosphère dépend de quelques paramètres : température de surface, pesanteur de la planète, masse des atomes, présence d'un chap magnétique, etc. Tous influencent divers phénomènes chimiques et gravitaires, qui font que la planète pourra garder ou non son atmosphère.
De plus, ces phénomènes qui permettent à une planète d'avoir une atmosphère sont les mêmes que ceux qui gouvernent la mise en place de l'atmosphère et sa composition chimique, ce qui fait parler de la présence d'une atmosphère et de sa composition chimique revient au même (ou presque). Aussi, nous allons parler en même temps de la composition chimique, des conditions d'existence d'une atmosphère et de leur évolution. Dans cette section, nous allons voir comment les atmosphères planétaires se sont mises en place, comment elles ont évolué, et comment cela a retenti sur leur composition chimique. Dans les grandes lignes, les planètes ont vu une première atmosphère se former en même temps qu'elles, par condensation de la nébuleuse protoplanétaire. Cette atmosphère primaire a été conservée sur certaines planètes, mais elle a disparu sur d'autres pour laisser la place à une atmosphère secondaire. Dans ce qui va suivre, nous allons d'abord parler de l'atmosphère primaire, avant de voir quels processus ont donné naissance aux atmosphères secondaires.
| Planète gazeuse/géante | Planète tellurique | Planète naine | Satellites et astéroïdes |
|---|---|---|---|
| Atmosphère primaire | Atmosphère secondaire (sauf pour mercure, qui n'a pas d'atmosphère) | Pas d'atmosphère | |
- À noter que les explications qui vont suivre sont assez simplifiées et que les réactions chimiques dans la nébuleuse devaient être beaucoup plus complexes et plus nombreuses. Mais il s'agit d'une première approximation qui fonctionne bien pour qui souhaite avoir un simple bagage minimum sur le sujet. Ces modèles peuvent prendre en compte non seulement la pression et la température, mais aussi les teneurs exactes en éléments chimiques, le potentiel rédox, le pH, et bien d'autres paramètres. Dans le domaine de la recherche, les modèles théoriques les plus perfectionnés peuvent utiliser plusieurs centaines d'équations chimiques de ce style et nécessiter des simulations informatiques pour être résolus.
L'atmosphère primaire
[modifier | modifier le wikicode]Les atmosphères primaires se sont formées en même temps que le système solaire, par accumulation des résidus gazeux de la nébuleuse primordiale. On les retrouve sur les planètes très massives, sur lesquelles l'atmosphère n'a pas pu s'évaporer et a donc été conservée telle quelle. Dans le système solaire, on les retrouve sur les planètes gazeuses Jupiter, Saturne, Neptune et Uranus, seules suffisamment massives pour conserver une atmosphère primaire.
En théorie, l'atmosphère primaire a une composition chimique qui dépend de la position de la planète dans le système solaire. N'oublions pas, que les atomes légers se sont éloignés du Soleil alors que les atomes lourds ont pu rester à proximité du Soleil, à cause du vent solaire et de la répartition thermique dans le disque protoplanétaire. Les planètes éloignées ont donc une atmosphère très riche en Hydrogène et en Hélium, alors que les plus proches sont riches en éléments plus lourds, comme l'Oxygène ou le Carbone. En pratique, dans le système solaire, les planètes géantes sont composées presque exclusivement d'Hydrogène et d'Hélium.
Les réactions chimiques dans la nébuleuse primordiale
[modifier | modifier le wikicode]L'atmosphère primaire était riche en Hydrogène, Hélium, Carbone, Azote et Oxygène, mais il ne faut pas oublier que ces éléments chimiques interagissent entre eux pour former des molécules. Connaître la composition atomique de la nébuleuse primordiale ne suffit donc pas à décrire correctement l'atmosphère primitive : il faut aussi savoir comment ils vont se combiner en molécules. Pour cela, on doit connaître les réactions chimiques possibles entre H, C, O N et He. Si l'Hélium n'interagit avec presque rien, les autres éléments peuvent former des molécules simples : ammoniac, gaz carbonique, méthane, eau, etc. Pour résumer ces réactions :
- L'hydrogène peut réagir avec lui-même pour former du dihydrogène .
- L'azote peut faire de même, ce qui forme alors du diazote .
- L'azote peut aussi réagir avec de l'hydrogène, ce qui donne de l'ammoniac .
- Le carbone peut réagir avec de l'hydrogène pour donner du méthane .
- Le carbone et l'oxygène peuvent réagir pour former du monoxyde de carbone ou du gaz carbonique .
- Enfin, hydrogène et oxygène peuvent réagir pour donner de l'eau .
Ces molécules peuvent ensuite réagir entre elles, pour former de nouvelles molécules pour détruire celles existantes. La recherche nous dit que les réactions chimiques pertinentes dans la nébuleuse primordiale semblent être les suivantes :
La première réaction nous dit que la nébuleuse peut se condenser pour donner du méthane et de l'eau, ou du monoxyde de carbone et du dihydrogène. La seconde nous dit qu'elle peut donner de l'ammoniac, ou du diazote et du dihydrogène. La troisième nous dit que le monoxyde de carbone peut réagir avec l'eau pour donner du gaz carbonique et du dihydrogène. On peut fusionner la deuxième et la troisième équation, ce qui permet de résumer le tout à un système à deux équations :
Pour résumer, la première réaction nous dit que la nébuleuse peut se condenser pour donner du méthane et de l'eau, ou du dioxyde de carbone et du dihydrogène. La seconde nous dit qu'elle peut donner de l'ammoniac, ou du diazote et du dihydrogène.
La répartition des molécules dans le système solaire interne et externe
[modifier | modifier le wikicode]À de faibles températures et/ou de fortes pressions, les réactions tendent à privilégier la formation des termes de gauche. C'est l'inverse pour les fortes températures et/ou les faibles pressions, qui poussent l'équilibre vers les termes de droite. On peut alors déterminer la composition de l'atmosphère primaire selon la température et la pression dans le disque protoplanétaire.
Dans le système solaire interne, la température est assez forte et la pression convenable. Les équations stœchiométriques précédentes nous disent que cela privilégie la formation de gaz carbonique, de dihydrogène et de diazote. Le monoxyde de carbone est aussi présent, mais il réagit rapidement avec l'eau si celle-ci est présente, donnant du gaz carbonique. Cela est bien illustré par la composition de leurs atmosphères, qui sont riches en et en . Cependant, on voit plusieurs points de divergence entre la composition chimique actuelle de leurs atmosphères et celle de la nébuleuse primordiale. Mais les raisons sont à voir dans l'évolution de ces atmosphères après la formation du système solaire.
Dans le système solaire externe, la température est très faible. L'hydrogène et l'Hélium sont courants, ce qui fait qu'ils ne sont pas le point limitant dans les équations précédentes. De plus, les faibles températures privilégient la formation de méthane, d'ammoniac et de vapeur d'eau. C'est exactement ce qu'on observe sur les planètes géantes, où les nuages d'ammoniac sont courants et le méthane abondant. De manière plus anecdotique, le milieu est chimiquement réducteur. L'hydrogène a alors tendance à réagir avec toutes les espèces chimiques présentes et donne des molécules courantes comme de l'eau ou du , ais aussi des espèces plus rares comme le , le et bien d'autres.
Les atmosphères secondaires
[modifier | modifier le wikicode]Sur les autres planètes, les atmosphères primaires ont évolué suite à divers phénomènes de fuites : le vent solaire a littéralement soufflé l'atmosphère primaire, les impacts de très grosses météorites ont fait de même, et ainsi de suite. Tout cela fait que l'atmosphère primaire a fini par disparaître et qu'une atmosphère secondaire s'est mise en place. Parmi les phénomènes qui ont donné naissance aux atmosphères secondaires, nous allons surtout parler de l'échappement gravitationnel, qui permet à l'atmosphère de s'"évaporer" progressivement et de perdre ses éléments chimiques légers. L'échappement gravitationnel a fait que les éléments chimiques légers que sont l'Hydrogène et l'Hélium ont quitté les atmosphères des planètes telluriques, ne laissant derrière eux que le Carbone, l'Azote, l'Oxygène et d'autres éléments lourds. Pour résumer rapidement, les espèces chimiques légères vont s’échapper de l'atmosphère sur les planètes légères et/ou chaudes, alors que des planètes massives et/ou froides les conserveront.
La preuve principale que les atmosphères planétaires sont des atmosphères secondaires est la suivante : les atmosphères planétaires n'ont pas la même composition chimique que le Soleil, qui est supposé avoir une composition chimique semblable à celle de la nébuleuse primordiale. La différence la plus pertinente est la composition en gaz nobles, des éléments chimiques peu réactifs. Les réactions chimiques avec les gaz nobles sont peu nombreuses et ont lieu dans des conditions particulières, ce qui fait qu'on peut considérer les gaz nobles comme chimiquement inertes. La composition en gaz noble est donc la moins touchée par les réactions chimiques qui ont lieu dans l'atmosphère. Et les concentrations en gaz nobles des atmosphères planétaires différent grandement de la concentration solaire.
L'échappement gravitationnel
[modifier | modifier le wikicode]Si on fait la liste des planètes sans atmosphère et qu'on la compare à celles qui en ont une, un point se dégage : toutes les planètes avec une atmosphère sont plus massives que celles qui n'en ont pas. Cette influence est facile à comprendre intuitivement : sans gravité, l'atmosphère s'échapperait dans l'espace. Il faut qu'une planète ait une gravité suffisante pour conserver son atmosphère, pour l'attirer suffisamment pour l'empêcher de s'enfuir.
Pour rendre compte de cet effet, il nous faut faire intervenir la vitesse de libération du gaz atmosphérique, à savoir la vitesse qu'il faudrait pour qu'une molécule s'échappe dans l'espace. Pour s'échapper dans l'espace, un objet doit atteindre la vitesse de libération. Si elle n'atteint pas cette vitesse, une particule de gaz restera dans l'atmosphère. La vitesse de libération se calcule avec la formule suivante :
- , avec la vitesse de libération, la masse de la Terre , la constante de gravitation de Newton et le rayon terrestre.
Les atomes et molécules de l’atmosphère ont une énergie cinétique, et donc une vitesse, qui dépend de la température. Évidemment, toutes les particules du gaz ont une vitesse différente, qui est donnée à l'équilibre par la distribution de Maxwell-Boltzmann. Mais on peut faire les calculs sans avoir à utiliser celle-ci, en prenant une vitesse représentative, comme la vitesse moyenne ou la vitesse la plus probable (qui correspondent à deux grandeurs différentes). Pour simplifier les calculs, nous allons prendre la vitesse la plus probable, qui est égale à :
- , avec la vitesse moyenne, la température, la constante de Boltzmann et la masse atomique.
On peut calculer la température nécessaire pour un atome de masse pour quitter l'atmosphère. Pour cela, on égalise la vitesse de libération avec la vitesse moyenne :
Après quelques manipulations algébriques, on peut isoler la température de libération :
Maintenant, omettons la constante . On a :
- En réalité, un calcul plus précis devrait prendre en compte le fait que la vitesse la plus probable est un mauvais indicateur. Certaines particules ont une vitesse supérieure, suffisante pour s'échapper de l'atmosphère et elles représentent le gros des fuites dans l'espace. Ce qui fait qu'il vaut mieux considérer la formule précédente comme une approximation qualitative.

Pour résumer, les particules massives ont besoin d'une température plus forte que les autres pour atteindre la vitesse de libération. Précisons que les calculs précédents valent aussi bien pour les éléments chimiques que pour des molécules. Ainsi, des molécules lourdes ont moins de chances de s'échapper gravitationnellement que les molécules légères. outre l'influence de la masse des atomes/molécules, il faut aussi prendre en compte la masse et la taille de la planète. Une planète grosse et massive aura besoin d'une température plus forte pour évaporer son atmosphère. C'est techniquement ce qu'on observe dans le système solaire. Le schéma ci-contre montre quelle est la vitesse de libération pour plusieurs éléments chimiques, indiqués par des droites, selon la masse de la planète. Les planètes sont indiquées sur ce schéma, ce qui permet de prédire quelle est la composition chimique de chaque planète.
On devine pourquoi Mercure et la plupart des satellites n'ont jamais eu d'atmosphère : leur gravité est trop faible pour maintenir des gaz à leur surface, à l'exception de Xénon qui est trop rare pour former une atmosphère. Les corps telluriques un peu plus massifs, comme Venus, Mars et la Terre, ont pu conserver les éléments lourds mais pas les éléments légers. Leur atmosphère s'est rapidement appauvrie en Hydrogène et en Hélium, alors que l'Oxygène, le Carbone et l'Azote sont restés. Cela explique pourquoi leurs atmosphères sont si pauvres en H et He, mais riches en eau, gaz carbonique et diazote. Enfin, les planètes massives, comme les planètes géantes, ont pu conserver leurs éléments légers, qui n'ont pas pu s'échapper. Elles ont donc gardé une composition chimique proche de ce qu'on trouve dans la nébuleuse primordiale et n'ont pas vraiment d'atmosphères secondaires, à quelques détails près.
Ce processus est aujourd'hui le seul moyen d'expliquer la teneur en deutérium des atmosphères de Venus et Mars. Sur Venus, les mesures donnent un rapport deutérium/hydrogène de plus de 100 à 150 fois celui de la Terre. La raison à cela est que le Deutérium est près de deux fois plus lourd que le protium, ce qui fait que sa température de libération est deux fois plus importante. L'hydrogène normal (le protium) a donc beaucoup plus de chances de s'échapper de l'atmosphère, du fait de son poids plus faible. L'atmosphère de Venus et Mars s'est donc appauvrie plus rapidement en hydrogène qu'en deutérium, le rapport D/H a augmenté rapidement en conséquence, au point d'atteindre sa valeur actuelle.
La formation des atmosphères secondaires : fuites et apports extérieurs
[modifier | modifier le wikicode]Outre ce processus d'évaporation causé par la température, d'autres processus favorisent la fuite des atomes atmosphériques dans l'espace.
- Les premières atmosphères ont notamment été dispersées par les impacts de météorites, très fréquents et de grande ampleur. Pour comprendre pourquoi, il faut savoir que les météorites explosent lors de l'impact, formant une gigantesque bulle de gaz et de poussières sous pression qui s'étend dans l'atmosphère. Si cette bulle de gaz atteint la vitesse de libération, elle peut emporter un peu d'atmosphère avec elle, dans l'espace.
- Le vent solaire, qui est tout de même un flux très puissant de particules, peut aussi souffler les atmosphères, comme une bourrasque trop puissante sur de la poussière. La formation du champ magnétique des planètes a fourni une protection contre le vent solaire, mais ce dernier a quand même eux assez de temps pour agir sur les planètes jeunes.
Ces phénomènes ont fait disparaître l'atmosphère primaire, qui a été remplacée par une atmosphère secondaire, née plus tard. L'atmosphère secondaire est apparue par l'effet de deux phénomènes d'apports d’éléments chimiques : les apports des météorites et le dégazage mantellique (volcanisme, hydrothermalisme). En particulier, le volcanisme et l'hydrothermalisme ont émis une grande quantité de gaz contenu dans le manteau, formant une seconde atmosphère composée de CO2, vapeur d'eau et SO2. Les apports météoritiques ont été plus réduits, mais ont quand même joué une part non-négligeable. Toujours est-il que l'atmosphère secondaire a perduré sur la plupart des planètes telluriques, vu qu'elle était composée d'atomes et de molécules plus lourds, que le vent solaire a eu du mal à souffler.
Le cas particulier de la Terre : l'apparition de la vie
[modifier | modifier le wikicode]Comme dit plus haut, Vénus et Mars se démarquent clairement de la Terre quand on regarde leur atmosphère. L'atmosphère terrienne est très riche en azote et en oxygène mais sur Vénus et Mars, les atmosphères sont riches en dioxyde de carbone et moins en azote. Cela s'explique pour plusieurs raisons. L’atmosphère terrienne était autrefois similaire à celle de Vénus et Mars. Mais la Terre disposait de beaucoup d'eau liquide, contrairement à ses sœurs. Si on regarde l'évolution de l'atmosphère terrestre, on voit que la teneur en dioxyde de carbone diminue, avant que la teneur en oxygène augmente. La teneur en dioxyde de carbone a diminué suite à l'altération aqueuse. La formation des carbonates a « pompé » du carbone atmosphérique pour l'intégrer aux sédiments carbonés. L'atmosphère de la Terre ressemblerait ainsi à celle de Venus et de Mars si tout le carbone contenu dans les carbonates était volatilisé. Par la suite, la teneur en oxygène a augmenté. La raison tient à la vie sur Terre, et précisément à l'apparition de la photosynthèse. Précisément, les premières bactéries photosynthétiques, les cyanobactéries ou algues bleues, ont décomposé le dioxyde de carbone atmosphérique pour former de l'oxygène (le carbone est localisé dans les êtres vivants).






































![{\displaystyle \ln {P(z)}=-K\left[-{\frac {\ln {\left(T_{0}-az\right)}}{a}}+k\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73e7a82bd20a0ea16a2aaf4529e93bd231046d0b)


![{\displaystyle \ln {P(z)}-\ln {P_{0}}=\left[\ln {\left(T_{0}-az\right)}\cdot {\frac {K}{a}}-K\cdot k\right]-\left[\ln {T_{0}}\cdot {\frac {K}{a}}-K\cdot k\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3aa9107ee7d6357729da359a2bf154ad6d01c464)

![{\displaystyle \ln {P(z)}-\ln {P_{0}}={\frac {K}{a}}\left[\ln {T}-\ln {T_{0}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35b3d3e17fd76fe9721caad6e0b6c12f9780c625)
































































































