Technologie/Moteurs thermiques/Moteur Diesel/Cycle de Carnot
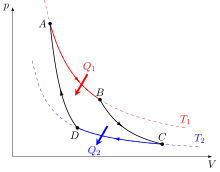

Le cycle de Carnot est un cycle thermodynamique idéal constitué de quatre processus réversibles : une détente isotherme, une détente adiabatique, une compression isotherme, et une compression adiabatique. C'est le cycle le plus efficace pour obtenir du travail à partir de deux sources de chaleur de températures constantes ; le cycle inverse est le moyen le plus efficace de transférer de la chaleur d'une source froide à une source chaude à partir d'une source de travail. L'efficacité des autres cycles et des machines réelles est comparée à celle du cycle de Carnot par le biais du rendement, un nombre sans dimension compris entre 0 (efficacité nulle) et 1 (efficacité parfaite).
Description du cycle
[modifier | modifier le wikicode]Sadi Carnot cherchait à faire un cycle avec la meilleure efficacité thermodynamique qui est le rapport de ce qui est récupéré sur ce qui a été dépensé. Elle est très souvent confondue avec le rendement qui est le rapport entre l'efficacité réelle et l'efficacité théorique maximale de la machine. Ainsi l'efficacité de toute machine thermodynamique peut être comparée avec l'efficacité de ce cycle. Il est composé de quatre processus (deux processus isothermes réversibles et deux adiabatiques réversibles) :
- 1 : Compression isotherme réversible (C→D) / (1→2) (sur respectivement : figures du haut / du bas)
- 2 : Compression adiabatique réversible (D→A) / (2→3)
- 3 : Détente isotherme réversible (A→B) / (3→4)
- 4 : Détente adiabatique réversible (B→C) / (4→1)
Le deuxième principe de la thermodynamique permet d'établir pour une transformation réversible :
avec:
- transfert thermique avec la source froide (compté négativement).
- transfert thermique avec la source chaude (compté positivement).
- température absolue de la source froide.
- température absolue de la source chaude.
L'efficacité de Carnot
[modifier | modifier le wikicode]
De nombreux systèmes thermodynamiques ont une efficacité définie à partir de celui du Cycle de Carnot, qui est un cycle purement théorique. En notant A l'aire géométrique de la transformation dans le diagramme de Clapeyron, c'est-à-dire l'opposé du travail W reçu par le système décrivant le cycle, on a :
et transfert thermique avec la source chaude, toutes les deux définies positives.
Donc pour chaque processus, en supposant que le fluide décrivant le cycle est un gaz parfait avec et en notant respectivement les températures des sources chaude et froide :
- 1-2 :
- car isotherme
- 2-3 :
- d'où :
- 3-4 :
- car isotherme
- 4-1 :
- d'où :
Donc, en tenant compte de , on a :
Avec les formules de Laplace pour les processus isentropiques :
d'où :
- 4-1 :
- 2-3 :
Et donc le rapport : donc : et finalement
En incorporant ceci dans l'équation de l'efficacité on obtient :
On voit donc qu'il est impossible d'obtenir une efficacité de 100%, même pour le cycle de Carnot moteur entièrement réversible, sauf pour le cas théorique
Deuxième principe de la thermodynamique
[modifier | modifier le wikicode]Le deuxième principe de la thermodynamique établit l'irréversibilité des phénomènes physiques, en particulier lors des échanges thermiques. C'est un principe d'évolution qui fut énoncé pour la première fois par Sadi Carnot en 1824. Il a depuis fait l'objet de nombreuses généralisations et formulations successives tout au long du XIXe siècle. Le second principe introduit la fonction d'état entropie : S, usuellement assimilée à la notion de désordre qui ne peut que croître au cours d'une transformation réelle.
Énoncé de la loi
[modifier | modifier le wikicode]Toute transformation d'un système thermodynamique s'effectue avec augmentation de l'entropie globale incluant l'entropie du système et du milieu extérieur. On dit alors qu'il y a création d'entropie.
- La fonction d'état entropie : , a été considérée comme une mesure du désordre.
Dans le cas d'une transformation réversible, la création d'entropie est nulle.
Remarques
- L'entropie d'un système isolé ne peut qu'augmenter ou rester constante puisqu'il n'y a pas d'échange de chaleur avec le milieu extérieur.
- L'entropie d'un système peut diminuer mais cela signifie que l'entropie du milieu extérieur augmente de façon plus importante ; le bilan entropique étant positif, ou nul si la transformation est réversible.
- L'expression « degré de désordre du système » introduite par Boltzmann peut se révéler ambigüe et subjective. En effet on peut aussi définir l'entropie comme une mesure de l'homogénéité du système considéré. L'entropie d'un système thermique est maximale quand la température est identique en tout point. De même, si on verse un liquide colorant dans un verre d'eau, l'entropie du système coloré sera maximale quand, suite au mélange, la couleur du contenu sera devenue uniforme. Tout système isolé, siège d'une agitation aléatoire, tend spontanément à s'homogénéiser de manière irréversible ce qui intuitivement semble contraire à une augmentation du désordre. Le second principe est un principe d'évolution qui stipule que toute transformation réelle s'effectue avec création d'entropie.
Notion de réversibilité
[modifier | modifier le wikicode]Une transformation réversible est une transformation quasistatique susceptible d'être inversée à la suite d'une modification progressive des contraintes extérieures, en permettant au système de retrouver les états antérieurs successifs. En fait cela revient à passer le film de la transformation à l'envers ! Si ce film paraît absurde c'est que la transformation n'est pas réversible. En réalité, toutes les transformations réelles sont irréversibles. Une transformation réversible représente en effet, le cas limite d'une transformation réelle, conduite d'une manière infiniment lente, constituée d'une suite d'états d'équilibre infiniment voisins et caractérisée par des phénomènes dissipatifs nuls. C'est donc un modèle idéal de transformation.
On peut recenser plusieurs causes d'irréversibilité (liste non exhaustive) :
- inhomogénéité (source de diffusion) : densité moléculaire, température, pression,...
- phénomène dissipatif : frottements fluides et solides
- réorganisation spontanée de la matière : réaction chimique.
Formulations du second principe
[modifier | modifier le wikicode]Le second principe introduit la fonction d'état extensive , appelée entropie. La variation d'entropie d'un système, lors d'une transformation quelconque, peut être décrite comme la somme d'un terme d'échange et d'un terme de création :
- Le terme de création, toujours positif ou nul, impose le sens de l'évolution de la transformation, ; l'égalité n'a lieu que pour une transformation réversible.
- Le terme d'échange dans le cas d'un système fermé échangeant la quantité de chaleur Q avec le milieu extérieur à la température T est égal à .
Une autre formulation est possible en considérant l'entropie du système et l'entropie du milieu extérieur. Cette formulation est totalement compatible avec la précédente.
En effet
correspond à l'entropie échangée par le système avec le milieu extérieur. Si l'on se place du côté du milieu extérieur le signe s'inverse d'après la règle des signes et donc :
Il s'ensuit
D'où
La variation d'entropie globale correspond à l'entropie créée et est égale à la somme des variations d'entropie du système et du milieu extérieur. Elle est toujours positive dans le cas des transformations réelles irréversibles. En revanche dans le cas idéal des transformations réversibles elle est nulle. Considérons une transformation effectuée soit de façon réversible soit de façon irréversible, à la température . L'entropie étant une fonction d'état sa variation sera la même pour les deux chemins envisagés. En revanche la chaleur dépendra du chemin suivi car elle n'est pas une fonction d'état.
- Transformation réversible :puisque l'entropie créée est nulle.
- Transformation irréversible :
Il s'ensuit que puisque l'entropie créée est positive.
L'expression ainsi obtenue a été formulée par Clausius. On l'appelle encore inégalité de Clausius. C'est une autre façon d'exprimer le second principe.
Conséquence sur le transfert thermique :
Intuitivement on sait que la chaleur passe d'un corps chaud à un corps plus froid. Le second principe permet de le démontrer. Considérons un système isolé constitué de deux sous-systèmes, syst1 et syst2 dont les températures respectives T1 et T2 sont différentes.
La chaleur échangée par syst1 est Q1 et celle échangée par syst2 est Q2. Comme le système est isolé la chaleur échangée avec le milieu extérieur est nulle, donc Q1 + Q2 = 0 . D'où Q2 = - Q1.
Appliquons le second principe
Scréée = ΔSsyst + ΔSext > 0
or ΔSsyst = ΔSsyst1 + ΔSsyst2 et ΔSext = 0 puisque le système est isolé.
Il s'ensuit :
Scréée = ΔSsyst1 + ΔSsyst2
ΔSsyst1 = Q1/T1
ΔSsyst2 = Q2/T2 = -Q1/T2
Donc Scréée = Q1/T1 - Q1/T2
Scréée = Q1 (1/T1 - 1/T2)
Comme la transformation est irréversible :
Scréée = Q1 (1/T1 - 1/T2) > 0
Si T1 est supérieure à T2, il faut que Q1 soit négative pour que le bilan entropique soit positif. D'après la règle des signes, cela signifie que le syst1 fournit la chaleur au syst2 qui la reçoit et donc que la chaleur passe du chaud au froid.
En toute rigueur, la température ne change pas brutalement entre les deux sous-systèmes car au voisinage de la frontière, la température varie progressivement entre T1 et T2. On dit qu'il y a un gradient de température ; phénomène intimement lié à la notion d'irréversibilité. Néanmoins ce phénomène ne s'oppose pas à la démonstration précédente démontrant le sens du transit de chaleur. Si les températures T1 et T2 sont très proches l'une de l'autre, on peut considérer que la transformation se rapproche d'une transformation réversible (petit déséquilibre de la variable température) et l'on constate alors que Scréée tend vers zéro.
Conséquence sur le travail utile fourni par un système :
Le travail ainsi que la chaleur ne sont pas des fonctions d'état et leur valeur dépend de la nature de la transformation affectant le système. Considérons une transformation effectuée soit de façon réversible soit de façon irréversible à la température T. La variation d'entropie sera la même car l'entropie est une fonction d'état. En revanche, W(rév)≠ W(irrév) et Q(rév)≠ Q(irrév).
ΔS(syst) = Q(rév)/T
ΔS(syst) > Q(irrév)/T
Donc Q(rév) > Q(irrév)
Appliquons maintenant le premier principe
ΔU = W(rév)+ Q(rév) = W(irrév) + Q(irrév)
Il en résulte que : W(rév)< W(irrév)
Or pour un système moteur fournissant du travail, le travail est compté négativement d'après la règle des signes choisie en thermodynamique. Ce qui est important c'est la valeur absolue du travail utile. D'où:
|W(rév)| > |W(irrév)|
Le travail utile fourni par un système moteur est plus important si la transformation est réversible.
Les frottements étant la principale cause d'irréversibilité on comprend pourquoi on essaye de les minimiser par la lubrification.
Historique de la loi
[modifier | modifier le wikicode]C'est Sadi Carnot dans le traité Réflexions sur la puissance motrice du feu et sur les machines propres à développer cette puissance, fut le premier à établir que l'efficacité thermodynamique d'une telle machine dépendait de la différence de température entre la source chaude et la source froide. Bien qu'utilisant le concept dépassé du calorique qui considérait que la chaleur, par analogie avec un fluide, était une substance matérielle qui ne pouvait qu'être soit ajoutée, soit enlevée, soit transférée d'un corps à un autre, il réussit, par une expérience de pensée, à proposer le principe suivant : l'efficacité maximale d'un moteur ditherme fonctionnant selon ce principle avec une source chaude de température (hot) et une source froide de température (cold) vaut :

Cette expression de l'efficacité de Carnot correspond au fonctionnement cyclique et réversible d'une machine ditherme. Au cours du cycle, la source chaude à la température TH fournit la quantité de chaleur QH au système moteur. Celui-ci fournit un travail W et restitue une quantité de chaleur QC à la source froide de température TC ( voir figure ).
Comme le fonctionnement est cyclique, l'état final est identique à l'état initial et l'énergie interne U du système reste constante car c'est une Fonction d'état, d'où ΔU = 0 .
Application du premier principe :
Donc
Toujours pour cette évolution cyclique réversible l'application du second principe donne :
d'où et
L'efficacité du moteur correspond au rapport du travail fourni (en valeur absolue) sur la chaleur qu'il a reçue de la source chaude
d'où :
Le cycle de Carnot étant réversible, l'efficacité obtenue est l'efficacité maximale théorique pour un moteur fonctionnant entre ces deux températures. Elle n'est jamais atteinte dans un cycle réel. Dans le cas d'une machine à vapeur d'eau, l'efficacité théorique maximale calculée pour TH = 373 K et TC = 298 K , serait égale à η = 0,2.
On retrouve également l'un des énoncés historiques du second principe de la thermodynamique en envisageant le cas où TH = TC. Dans ce cas, l'efficacité est nulle et le moteur ne fournit donc aucun travail. Ceci constitue l'énoncé de Thomson du second principe : Un système en contact avec une seule source ne peut, au cours d'un cycle, que recevoir du travail et fournir de la chaleur.
Autres interprétations et conséquences du second principe
[modifier | modifier le wikicode]Transfert d'extensité
[modifier | modifier le wikicode]Une autre interprétation, plus « physique » du second principe peut être formulée. En effet, un cylindre creux fermé hermétiquement aux deux extrémités. Aussi un piston libre de se déplacer dans ce cylindre. Si l'on déplace le piston vers la gauche, la partie gauche voit sa pression augmenter et son volume diminuer et, vice-versa, la partie droite voit sa pression chuter et son volume augmenter. Si l'on relâche le piston, il va spontanément se déplacer vers la droite, vers sa position d'équilibre initiale. Le déplacement se fait donc de la partie à haute pression, qui voit son volume augmenter, vers la partie à basse pression qui voit son volume chuter. Si l'on se souvient que la grandeur intensive est ici la pression et que la grandeur extensive est ici le volume, cet exemple illustre l'énoncé suivant correspondant à une autre formulation du second principe :
L'énergie s'écoule toujours de la haute intensité vers la basse intensité par un transfert d'extensité.
Dans ce cas :
Si l'on met en contact deux objets à potentiels électrostatiques différents, l'énergie ira du plus haut potentiel (grandeur intensive) vers le plus bas par un transfert de charges (grandeur extensive) : .
De même, si l'on met en contact deux sources à températures différentes, la chaleur s'écoulera de la source à haute température vers celle à basse température par transfert d'entropie. L'entropie est donc l'extensité associée à la forme énergétique appelée chaleur : .
Second principe et chaos
[modifier | modifier le wikicode]Ludwig Boltzmann a étudié le second principe sous son aspect microscopique ce qui a révolutionné la physique, on raisonne en effet sur un grand nombre de particules indiscernables, indépendantes et identiques. Dans ce cas, l'entropie d'un macro-état Ω est défini (de façon statistique) par la formule de Boltzmann : .
Ω correspond au nombre de micro-états différents observables dans un macro-état donné.
Les cycles de Poincaré
[modifier | modifier le wikicode]Le mathématicien Henri Poincaré démontra en 1890 un théorème extrêmement général, dont l'énoncé physique est : « Tout système macroscopique repasse une infinité de fois aussi près que l'on veut de son état initial ». Ce « théorème de récurrence » fut opposé au second principe, car il implique que toute évolution macroscopique est réversible. Pour contrer ce théorème apparemment inattaquable, Boltzmann calcula le temps nécessaire à 100 cm3 de gaz pour revenir à son état initial. Il trouva années. Autant dire que, si le problème des cycles de Poincaré subsiste, il n'est pas d'une urgence brûlante.
La boîte de Maxwell
[modifier | modifier le wikicode]Soit une boîte circulaire plate, horizontale, partagée par une cloison en deux compartiments égaux, et contenant N palets blancs et N palets noirs, de même rayon r, glissant sans frottements sur le fond. Ouvrir un passage dans la cloison, d'une grandeur supérieure à 2r, pour permettre le passage des palets. Secouer, puis immobiliser la boîte. Il est assez intuitif que l'état le plus souvent réalisé se rapprochera de N/2 palets blancs et N/2 palets noirs dans chaque compartiment mais avec d'immenses fluctuations, d'autant plus grandes en valeur absolue que la boîte sera grande et que N sera grand. Ces fluctuations croissent en effet comme . Mais plus N est grand, plus ces fluctuations seront négligeables devant N et la répartition se rapprochera de N/2 pour chaque couleur de palet dans chaque compartiment. On remarque ici un autre aspect du second principe qui montre que l'évolution spontanée d'un système va toujours vers l'homogénéité.




























































