Neurosciences/L'influx nerveux
Dans le chapitre précédent, j'ai dit que les neurones échangent des signaux électriques, mais sans vraiment rentrer dans le détail. C'est maintenant que l'on rentre dans le vif du sujet. Mais avant toute de chose, un petit point de vocabulaire : nous ne parlerons plus d'influx nerveux, mais de potentiel d'action. La différence est qu'un courant électrique est un déplacement de charges électriques, alors que le potentiel d'action est une variation de tension de surface du neurone.

Le potentiel de repos[modifier | modifier le wikicode]
Avant le passage du potentiel d'action, le neurone est au repos. Si on mesure la tension à la surface de la membrane du neurone, on trouve que celle-ci n'est pas nulle : il y a une différence de tension entre la face interne et la face externe de la membrane. Cette tension est ce qu'on appelle le potentiel de repos. Généralement, sa valeur est d'environ -70 millivolts : la face interne est plus négative que l'extérieur. Ce n'est pas valable que pour les neurones, mais aussi pour un grand nombre de cellules vivantes : cette différence de potentiel joue un rôle dans certaines réactions chimiques utiles aux cellules. Le potentiel de repos existe parce qu'il y a moins d'ions positifs à l'intérieur de la cellule qu'à l'extérieur. Le neurone est donc chargé en ions négatifs alors que les ions positifs sont plus concentrés en dehors. Comprendre l'origine du potentiel de repos demande tout simplement de comprendre l'origine de cette différence de concentrations ioniques entre l'intérieur et l'extérieur du neurone.

La création d'une différence de concentration : les pompes ioniques[modifier | modifier le wikicode]
Pour créer le potentiel de membrane, le neurone crée des différences de concentrations en ions des deux côtés de la membrane et exploite ces différences de concentration pour créer le potentiel de repos. Pour cela, le neurone doit expulser des charges positives à l'extérieur de la cellule, ce qui est fait grâce à des pompes ioniques, des protéines qui expulsent des substances chimiques hors de la cellule. Bien évidemment, cette expulsion demande de consommer l'énergie : la pompe consomme de l'énergie (sous forme d'ATP). En effet, les ions ont naturellement tendance à vouloir égaliser les concentrations. Or, la concentration en ions potassium est plus élevée à l'extérieur qu'à l'intérieur de la cellule. Afin d'équilibrer ces concentrations, et à cause de la différence de charge entre l'extérieur et l'intérieur, ces ions positifs auraient tendance à rentrer dans la cellule, d'où la nécessité de consommer de l'énergie pour les expulser.
Pour le potentiel de membrane, les pompes ioniques sont des pompes sodium-potassium, qui échangent trois atomes de sodium contre deux atomes de potassium. Le sodium est expulsé hors de la cellule, alors que le potassium est capté vers l'intérieur : il y a donc une concentration supérieure en sodium à l'extérieur de la cellule, alors que la concentration en potassium est supérieur à l'intérieur de la cellule. On peut remarquer que cette pompe suffit à elle seule à créer un léger potentiel de repos : pour trois ions sodium qui sortent, deux de potassium rentrent. Si on fait le bilan des charges électriques, on se retrouve avec une charge positive en moins à chaque échange d'ions. Cette pompe entretient donc un léger potentiel de membrane. Mais cette pompe n'est pas la seule, et si on fait les calculs, et ou qu'on effectue quelques expériences, on se rend rapidement compte que le potentiel crée ainsi devrait être de 10 à 20 millivolts, pas plus. Comment expliquer le fait que le potentiel de repos soit 4 à 7 fois plus élevé ? Cette question nous amène fatalement à une autre question.

La création du potentiel de membrane : les canaux ioniques[modifier | modifier le wikicode]

Le neurone peut exploiter cette différence de concentration pour créer un potentiel de repos. Il lui suffit d'ajouter des portes qui ne laissent passer qu'un seul type d'ion à travers la membrane de la cellule. Ces portes qui ne laissent passer qu'un seul type d'ion sont ce qu'on appelle des canaux ioniques. Ce sont des protéines qui laissent passer les ions, sauf que, contrairement aux pompes, le transport se fait de la plus forte concentration vers la plus faible et ne peut pas aller dans l'autre sens. Ils peuvent s'ouvrir ou se fermer, ce qui permet de laisser ou d’empêcher les ions de passer au travers de la membrane. Un canal ouvert laisse rentrer des ions, ce qui diminue un peu le potentiel de membrane. En raison de la présence de ces canaux ioniques, la membrane d'un neurone a ce qu'on appelle une perméabilité aux ions. Évidemment, plus il y a de canaux ioniques ouverts (qui laissent passer les ions), plus la perméabilité est importante. Ces canaux ioniques ne laissent passer qu'un seul type d'ion. Par exemple, il existe des canaux ioniques qui ne laissent passer que le potassium, mais ne laissent pas passer les autres éléments. De même, il y a des canaux qui laissent passer le sodium, mais qui ne laissent pas passer le potassium, le chlore, le calcium, ou tout élément chimique ou molécule. Les canaux ioniques sont donc sélectifs, spécialisés dans un seul ion bien précis.
Le cas avec un seul type de canaux ionique[modifier | modifier le wikicode]
Pour comprendre en quoi ces canaux permettent de créer un potentiel, nous allons prendre un exemple simplifié. Si la pompe sodium-potassium crée la différence de concentration vue plus haut, les deux côtés de la membrane cellulaire sont neutres électriquement : la charge des ions potassium et sodium est compensée par un ion négatif de même concentration, qu'on appellera ion compensatoire. Ensuite, nous allons supposer qu'il n'y a que des canaux ioniques au potassium. Le sodium et l'ion négatif compensatoire ne passent pas à travers ces canaux, ce qui fait que la quantité de charges négatives dans la cellule ne change pas. Par contre, l'ion potassium va passer, afin d'égaliser la concentration des deux côtés de la cellule. Ces ions potassium qui traversent les canaux sont autant de charges positives qui quittent la cellule. En clair, il y a aura plus de charges négatives que de charges positives dans la cellule : on obtient une différence de potentiel, source d'une force électrique qui retient les ions potassium dans la cellule. Au début du processus, cette force électrique ne sera pas suffisante pour empêcher les ions de sortir, l'effet de la concentration étant largement supérieur. Mais plus les charges électriques quittent la cellule, plus la différence de tension augmentera : la force électrique, proportionnelle à cette différence de tension, augmentera donc. Il arrive un moment où ces deux forces s'équilibrent : les ions ne sortent pas plus du neurone qu'ils n'y rentrent. Dit autrement, le flux d'ions à travers la membrane est nul (les entrées compensent les sorties). C'est à ce moment que le potentiel de repos est atteint.
Ce que l'on vient de dire peut s'appliquer en remplaçant l'ion potassium par n'importe quel ion. On peut alors calculer la différence de potentiel atteinte à ce moment-là en utilisant l'équation de Nernst. Les notations utilisées sont :
- V : différence de potentiel ;
- R : constante des gaz parfait ;
- T : température ;
- z : charge de l'ion considéré ;
- F : constante de Faraday ;
- : concentration de l'ion à l'extérieur de la membrane ;
- : concentration de l'ion à l'intérieur de la membrane ;

Le cas avec plusieurs types de canaux ionique[modifier | modifier le wikicode]
Maintenant, voyons ce qui se passe avec deux canaux ioniques, pour les ions sodium et potassium. Dans ce cas, le potentiel sera intermédiaire entre le potentiel obtenu avec du sodium et celui avec du potassium. La valeur exacte dépendra des concentrations exactes de chaque ion : plus il y a de potassium, plus la tension sera proche -58 millivolts, par exemple. Le cas d'un vrai neurone est cependant plus compliqué : il n'y a pas qu'un seul type de canaux ionique, mais plusieurs : certains laissent passer le sodium, d'autre le calcium, d'autre le potassium, d'autres le chlore, etc. De plus, les pompes font sortir certains ions de la cellule, mais en font rentrer d'autres. Mais dans les grandes lignes, la contribution la plus importante au potentiel de repos est celle du potassium, les autres espèces ayant très peu de canaux ioniques ouverts.

En présence de plusieurs types de canaux ioniques, le potentiel de membrane ne peut plus être calculé avec l'équation de Nernst. Il faut, à la place, utiliser une équation plus générale appelée l'équation de Goldman-Hodgkin-Katz. Nous allons la donner pour le cas où il existe trois canaux ioniques : au sodium, au potassium et au chlore. Les notations utilisées sont :
- : perméabilité de la membrane à l'ion chlore ;
- : perméabilité de la membrane à l'ion potassium ;
- : perméabilité de la membrane à l'ion sodium.
- : concentration de l'ion chlore à l'extérieur de la membrane ;
- : concentration de l'ion potassium à l'extérieur de la membrane ;
- : concentration de l'ion sodium à l'extérieur de la membrane ;
- : concentration de l'ion chlore à l'intérieur de la membrane ;
- : concentration de l'ion potassium à l'intérieur de la membrane ;
- : concentration de l'ion sodium à l'intérieur de la membrane.
Les oscillations intrinsèques du potentiel de membrane[modifier | modifier le wikicode]
Nous venons de voir le potentiel de repos et les mécanismes qui en sont à l'origine. Ce faisant, on pourrait croire que le potentiel de la membrane du neurone est constant, tant qu'il n'est soumis à aucune stimulation. Si un neurone ne reçoit pas de potentiel d'action et que son environnement ionique est stable, on s'attend à ce que la membrane soit au potentiel de repos. Mais en réalité, certains neurones ne respectent pas cette règle. Sur ces neurones, on observe de variations du potentiel de membrane, certaines semblant aléatoires, d'autres semblant au contraire particulièrement régulières. Cela n'a rien d'étonnant : on s'attend à ce qu'il y ait un peu de bruit électrique, qui se traduit par de petites variations aléatoires de tension. Mais certains neurones montrent, en plus du bruit électrique ambiant, des variations régulières, périodiques, cycliques, du potentiel de membrane. De telles variations sont appelées des oscillations intrinsèques du potentiel de membrane.
Les oscillations en question sont des variations périodiques de la tension de membrane. Si on trace un graphe de la tension en fonction du temps, on voit que les oscillations forment une belle sinusoïde, dans un cas idéal (en réalité, il y a toujours du bruit qui vient perturber les mesures et la tension de membrane). Le temps mis pour effectuer un cycle complet est appelé la période et le nombre de cycles par secondes est appelé la fréquence. Les oscillations intrinsèques ont une fréquence assez basse, allant de quelques Hertz (un Hertz = une oscillation par seconde) à quelques dizaines de Hertz. L'amplitude de ces oscillations, c’est-à-dire l'ampleur entre la tension minimale et maximale, est de quelques millivolts à quelques dizaines de millivolts, rarement plus. Pour donner un exemple, les neurones du cortex entorhinal du singe ont une fréquence d'oscillation comprise entre 4 et 18 Hz, avec une amplitude de 10 mV.
L'origine de ces oscillations est assez bien connue, bien que les mécanismes exacts dépendent du type de neurone considéré. Les scientifiques arrivent à modéliser ce phénomène en utilisant des modèles mathématiques de neurones que nous verrons dans un chapitre annexe ultérieur (des extensions des modèles de Hodgin-Huxley ou de Morris–Lecar). L'explication est cependant assez mathématique, comme nous le verrons. Mais on sait que ces oscillations sont liées aux canaux ioniques, à leur rapidité à se fermer/s'ouvrir, et à d'autres paramètres du genre. Diverses expériences ont montré que les oscillations peuvent être modulées, voire abolies, quand on modifie l'équilibre ionique du neurone. Par exemple, chez certains neurones bien précis, on peut réduire les oscillations en réduisant la concentration en sodium/calcium de l'environnement extracellulaire, ou encore en faisant pareil pour le potassium à l'intérieur du neurone. On devine donc une implication des canaux ioniques dans l'apparition des oscillations.
L'utilité de ces oscillations n'est pas bien connue avec certitude, si tant est qu'il y en ait une. Néanmoins, un faisceau d'arguments théoriques et empiriques, ainsi que des simulations, semblent indiquer un rôle dans le traitement de l'information, qui reste malgré tout encore mal connu. L'influx nerveux sert naturellement à transmettre de l'information entre neurones, information qui est intégrée et traitée par les réseaux de neurones. Les oscillations auraient un rôle à jouer dans le traitement de cette information, en servant de signal de référence temporel. Elles joueraient un rôle assez similaire au signal d'horloge des circuits électronique, à savoir un signal qui cadence les neurones et permet de les synchroniser. De plus, elles serviraient aussi pour représenter de l'information dans l'influx nerveux : le temps d'arrivée d'un influx nerveux, par rapport à l'oscillation, pourrait coder de l'information. Mais tout cela est encore en débat et on ne sait pas si ces oscillations ont bien un rôle physiologique réel.
Le potentiel d'action[modifier | modifier le wikicode]
Maintenant, étudions ce qui se passe quand un neurone est soumis à une stimulation quelconque : un influx nerveux, par exemple. Regardons ce qui se passe à un endroit de la surface d'un axone quand un influx nerveux passe et que la tension augmente. Si le potentiel reste en dessous d'un certain seuil, il ne se passe rien : le potentiel revient rapidement au potentiel de repos. Il faut absolument que ce seuil soit dépassé pour que le potentiel soit créé. Mais si jamais le seuil est dépassé, un potentiel d'action se forme : le potentiel à la surface du neurone augmente rapidement jusqu’à une valeur maximale et redescend.

Insistons sur le fait que le potentiel de la membrane doit dépasser un seuil bien précis, sans quoi le potentiel d'action ne survient pas. Tous les neurones voient leur potentiel de membrane varier, mais ces variations n'ont pas d'effet tant qu'elles restent sous le seuil en question.

La forme d'un potentiel d’action[modifier | modifier le wikicode]
Le déroulement d'un potentiel d'action est toujours le même. Un potentiel d'action suit une série d'étapes stéréotypées, qui ne changent pas d'un potentiel d'action à l'autre :
- d'abord le potentiel monte : c'est une dépolarisation ;
- puis il redescend : c'est la repolarisation ;
- durant un temps relativement bref, le potentiel a une valeur inférieure au potentiel de repos : c'est une hyperpolarisation ;
- et puis le potentiel revient à la valeur normale du potentiel de repos.

Ce potentiel d'action a systématiquement la même forme et la même intensité : tous les potentiels d'action sont identiques. Vu que celui-ci a toujours la même amplitude, on dit que les potentiels d'action sont générés en tout ou rien. Ainsi, l'amplitude du potentiel d'action n'a aucun impact dans le transfert d'informations entre neurones. Nous verrons dans quelques chapitres comment les potentiels d'action peuvent coder de l'information. Pour le simplifier fortement, les informations sont surtout représentées au niveau d'un neurone par la fréquence d'émission des potentiels d'action. Prenons l'exemple d'un neurone sensoriel qui capte un stimulus précis : l'intensité du stimulus sera représentée par la fréquence d'émission de potentiels d'action par le neurone sensoriel. Même chose pour un neurone moteur : l'intensité de la contraction musculaire induite par le neurone sera proportionnelle à la fréquence d'émission des potentiels d'action par le neurone moteur.
La production d'un potentiel d'action[modifier | modifier le wikicode]
L'origine du potentiel d'action tient dans le fait que les canaux ioniques peuvent se fermer ou s'ouvrir suivant les circonstances. Les canaux fermés ne laissent pas passer les ions, alors que les canaux ouverts les laissent passer. En clair, les canaux ioniques ont une perméabilité variable. Mais ceux-ci ne restent pas ouverts indéfiniment et se referment progressivement avec le temps. Divers phénomènes permettent d'ouvrir ou de fermer des canaux :
- les canaux dépendants du voltage s'ouvrent quand une tension seuil est atteinte ;
- les canaux chimio-dépendants s'ouvrent quand une substance chimique précise réagit chimiquement avec eux ;
- d'autres s'ouvrent quand on les étire ou qu'on les chauffe : ce sont des canaux utilisés pour les sensations du toucher et de la température.

Nous verrons plus en détail les canaux chimio-dépendants dans quelques chapitres, quand nous parlerons des récepteurs synaptiques. Ces récepteurs sont des protéines sur lesquels des molécules appelées neurotransmetteurs vont se lier. Les neurotransmetteurs sont émis par un neurone à destination d'un autre, ils servent de médium de transmission des potentiels d'actions entre neurones. Nous apprendrons alors qu'une grande partie des récepteurs synaptiques sont des canaux ioniques chimio-dépendants. Les canaux qui s'ouvrent quand on les étire ou les chauffe seront abordés dans les chapitres sur le toucher ou la sensation de la température. Pour le moment, nous n'avons besoin que des canaux ioniques dépendants du voltage. Ceux-ci sont des molécules formées de trois grandes parties, trois sous-molécule à la fonction précise. La première est simplement le pore, le trou qui laisse passer l'ion. La seconde est une sorte de porte, un clapet qui se ferme ou s'ouvre selon les circonstances. La troisième molécule joue le rôle d'un capteur qui agit sur le clapet pour ouvrir ou fermer le pore. Pour résumer, un canal ionique est composé d'un pore, d'une porte (pore gate) qui ouvre ou ferme le pore et d'un senseur qui décide de l’ouverture/fermeture.

Le déroulement simplifié d'un potentiel d'action[modifier | modifier le wikicode]
Pour simplifier, nous n'allons utiliser que deux types de canaux : un pour le potassium et un autre pour le sodium. On a vu précédemment que le potentiel d'action dépend des ions que l'on laisse passer par les canaux ioniques : vous aurez un potentiel de -58 millivolts en ne laissant passer que du potassium, alors que du sodium donnera un potentiel de +58 millivolts. Cela suffit à expliquer dans les grandes ligne le déroulement d'un potentiel d'action. Au potentiel de repos, sans influx nerveux entrant, les canaux sodium et potassium dépendants du voltage sont presque tous fermés. Seuls les canaux ioniques permanents (non-dépendant du voltage) sont ouverts, ce qui donne un potentiel de repos. Au début d'un potentiel d'action, des canaux au sodium vont s'ouvrir ce qui fait montrer la tension vers 58mV : c'est la dépolarisation. Ces canaux vont se fermer tandis que des canaux potassium vont s'ouvrir, ce qui fait redescendre la tension vers les -58mV : c'est la repolarisation. Pour résumer, du sodium rentre dans le neurone lors de la dépolarisation, alors que du potassium rentre dans la repolarisation.
| Étape du potentiel d'action | Dépolarisation | Repolarisation | Repos |
|---|---|---|---|
| Canaux sodium dépendants du voltage | Ouverts | Fermés | Fermés |
| Canaux potassium dépendants du voltage | Fermés | Ouverts | Fermés |
Le déroulement détaillé d'un potentiel d'action[modifier | modifier le wikicode]

En réalité, les choses sont un petit plus complexes que le schéma précédent, qui n'explique pas l'hyperpolarisation et décrit assez mal la dépolarisation. Lors de la dépolarisation, des canaux au sodium s'ouvrent et le potentiel se rapproche alors du potentiel de +58 millivolts. Cependant, ce processus demande que suffisamment de canaux s'ouvrent. Si la tension n'atteint pas un certain seuil, les canaux finiront par se fermer plus vite que l'augmentation de tension ne les ouvre : aucun potentiel d'action ne sera émis. Mais si la tension passe au-delà d'un certain seuil, l'ouverture des canaux s'emballera : l'ouverture de ces canaux va alors augmenter la tension, entraînant l'ouverture d'encore plus de canaux ioniques, qui eux-mêmes causeront une augmentation de tension, et ainsi de suite.
Il faut noter que les canaux potassium commencent à s'ouvrir lors de la dépolarisation, et non au début de la repolarisation. Ces canaux s'ouvrent quand la tension augmente, mais plus lentement que les canaux sodium. Les canaux potassium commencent à s'ouvrir lors de la dépolarisation, mais trop lentement pour que cela se fasse sentir. Le courant maximal de potassium a donc lieu quand la tension est proche de son maximum dans le potentiel d'action, ce qui cause la repolarisation. Leur influence deviendra pleine et entière lors de l'étape de repolarisation. Pour résumer, leur ouverture est très légère lors des phases de polarisation (pour ne pas dire inexistante), se fait sentir dans la repolarisation, et est à son apogée lors de l'hyperpolarisation.
L'hyperpolarisation vient du fait que le canal sodium a une particularité : une fois fermé, il faut un certain temps avant de pouvoir le rouvrir. Le canal potassium a donc trois états : un état ouvert, un état fermé où il peut être ouvert suite à une stimulation et un état inactif où il ne peut pas être ouvert. Le canal passe respectivement de l'état fermé à ouvert, puis à l'état inactif, avant de redevenir fermé : fermé -> ouvert -> inactif -> fermé. L'hyperpolarisation est due au fait que les canaux potassium restent ouverts alors que les canaux au sodium sont tous inactifs. Il y a plus de canaux potassium ouverts que lors du repos, et tous les canaux sodium sont "fermés" : la tension est donc inférieure au potentiel de repos.
| Étape du potentiel d'action | Dépolarisation | Repolarisation | Hyperpolarisation | Repos |
|---|---|---|---|---|
| Canaux sodium dépendants du voltage | Ouverts | Inactifs (en cours de fermeture) | Inactifs (tous fermés et inactifs) | Fermés |
| Canaux potassium dépendants du voltage | Fermés (en cours d'ouverture) | Ouverts | Ouverts | Fermés |
Après un potentiel d'action, les canaux sodium sont en état inactif et ne peuvent pas s'ouvrir. Cela fait qu'il y a un certain temps avant qu'un nouveau potentiel d'action puisse survenir : le temps que les canaux sodium repassent en état fermé (et non inactif). À cause de l'hyperpolarisation, la surface qui a émis un potentiel d'action a peu de chances d'en réémettre durant l'hyperpolarisation. Cette propriété est assez intéressante : c'est elle qui explique pourquoi le potentiel d'action ne se propage que dans un sens : si un endroit a émis un potentiel d'action, les potentiels d'action induits dans le voisinage ne peuvent pas déclencher un nouveau potentiel d'action à l'endroit de leur potentiel d'action source.
La propagation d'un potentiel d'action[modifier | modifier le wikicode]
Imaginons que le potentiel augmente à un endroit de la surface du neurone : toute la surface de l'axone n'est pas concernée, mais la portion où les canaux ioniques se sont ouvert l'est. Ainsi, la tension électrique à cet endroit augmente, alors que la tension reste au potentiel de repos sur le reste du neurone. Cette différence de tension va créer un courant électrique : les ions potassium et sodium se propagent à travers l'axone, de la zone de plus forte tension vers les zones de plus basse tension. C'est une conduction passive, guidée par un courant électrique. Cette conduction n'est pas très efficace, pour une raison simple : les ions fuient à travers la membrane, beaucoup trop perméable aux ions. En conséquence, la tension causée par cette conduction passive diminue exponentiellement avec la distance.

Maintenant, imaginons qu'un potentiel d'action ait lieu à un endroit du neurone et y fasse rentrer des ions. Les ions, une fois rentrés dans le neurone, vont se disperser autour du point d'entrée. L'augmentation du nombre d'ions va naturellement se répercuter sur la tension de la membrane, qui augmente/diminue. Vu que les ions se dispersent, la tension augmente sur une portion assez importante de la surface du neurone, autour du premier potentiel d'action. Or, l'augmentation de la tension est suffisante pour générer un nouveau potentiel d'action, juste à côté du premier. Dans ces conditions, le potentiel d'action saute d'un endroit à un autre, de proche en proche. Notons que le potentiel d'action ne revient pas en arrière et se propage le long de l'axone dans un seul sens. La raison à cela est que les canaux ioniques finissent par se refermer après un certain temps et ne se rouvrent pas de suite. Il se passe toujours un temps minimum entre la fermeture d'un canal ionique et sa réouverture, temps qui est appelé la période réfractaire. Durant cette période réfractaire, le potentiel d'action a eu le temps de s'éloigner suffisamment et ne peut plus agir sur les canaux ioniques lorsqu'ils sont prés à être rouverts.


On a vu au chapitre précédent que les oligodendrocytes et les cellules de Schwann augmentent la vitesse de conduction de l'influx nerveux en entourant les neurones de myéline. La raison est simple : cette gaine de myéline est isolante et imperméable aux ions. En clair, elle empêche les ions de fuir hors du neurone, augmentant la conduction passive. Cependant, cette gaine n’empêche pas seulement les ions de sortir, mais aussi de rentrer : les canaux ioniques ne pourraient pas vraiment faire leur travail si tout l'axone était recouvert. En réalité, la gaine de myéline ne recouvre pas entièrement l'axone, mais laisse des espaces libres : les nœuds de Ranvier. Sur ces nœuds, les canaux ioniques peuvent faire leur travail et générer de nouveaux potentiels d'action. Ainsi, les potentiels d'action sautent d'un nœud de Ranvier au suivant.

Les potentiels d'action dendritiques[modifier | modifier le wikicode]

Précisons une chose quant au sens de propagation du potentiel d'action. Rappelons que le potentiel d'action est généré au niveau du soma, du corps cellulaire du neurone. Il se propage donc dans l'axone, mais aussi dans l'autre sens, à travers les dendrites ! Cette propagation des potentiels d'action dans les dendrites porte le doux nom de propagation rétrograde (backpropagation). Mais le potentiel d'action ne se propage pas à l'identique sur les dendrites et sur l'axone. Il faut dire que les canaux ioniques ne sont pas les mêmes sur l'axone et les dendrites : leur seuil d'activation est plus fort sur les dendrites.
Cela a plusieurs conséquences. Par exemple, cela rend plus rare l’occurrence de potentiels d'action. Aussi, le potentiel d'action dendritique est généré avec un peu de retard comparé au potentiel d'action axonal, comme illustré sur le schéma ci-contre. De plus, le potentiel d'action s'atténue dans les dendrites, bien plus vite que dans l'axone : sur la plupart des neurones, il disparaît avant d'avoir atteint le bout des dendrites et reste concentré sur les zones proximales des dendrites. Enfin, la propagation du potentiel d'action est plus lente dans les dendrites.

Les troubles de l'influx nerveux[modifier | modifier le wikicode]
La génération et la propagation des potentiels d'action peut être dégradée par diverses maladies, que nous allons aborder dans ce qui suit. Il est possible de diviser les troubles du potentiel d'action en deux : les troubles de la génération du potentiel d'action et ceux de sa propagation. Dans le premier cas, le potentiel d'action n'est pas généré ou l'est trop facilement, comparé à un sujet sain dans des conditions identiques. Pour les troubles de la propagation, c'est la vitesse de l'influx nerveux qui est altérée, sa transmission pouvant être totalement abolie à certains endroits. Leurs causes peuvent être assez variées, allant de la simple carence en ions à des maladies plus graves comme la sclérose en plaques.
Ces maladies du potentiel d'action touchent l'ensemble du système nerveux, ce qui entraîne des manifestations assez variées, mais aussi le reste du corps. Elles touchent tout tissu sensible aux potentiels d'action, qui regroupent essentiellement les muscles (dont le cœur) et le système nerveux. Pas étonnant donc que ces troubles s’accompagnent surtout de manifestations cardiaques ou musculaires, en plus des manifestations neurologiques. La raison à cela est que la contraction de tout muscle est le fait d'un potentiel d'action, qui agit sur le muscle. Si le muscle ne peut pas propager un potentiel d'action sur sa surface, sa contraction est le plus souvent abolie. Cela vaut aussi pour le muscle cardiaque, qui est lui aussi traversé par des potentiels d'action, mais avec une petite différence : le cœur génère lui-même ses propres potentiels d'action, régulièrement, sans aide du cerveau. Toute contraction cardiaque est la conséquence d'un potentiel d'action généré par le cœur, le cerveau ne commandant pas la contraction cardiaque. Si ces potentiels d'actions sont extrêmement différents des potentiels d'action neuronaux, ils sont générés de la même manière que ces derniers : par échange d'ions à travers des canaux ioniques. Il va de soi que toute maladie des canaux ou des ions va toucher aussi bien le cœur que le cerveau ou les muscles, avec parfois des effets différents selon l'organe.
Les carences ou excès en ions[modifier | modifier le wikicode]
La génération des potentiels d'action peut être perturbée de deux manières : soit par une concentration anormale d'ions extra ou intra-neurone, soit par des défauts dans le fonctionnement des pompes et canaux ioniques. Le premier cas correspond à un manque ou un excès d'ions dans le corps, par exemple une carence en potassium ou en sodium. Les carences qui perturbent la génération des potentiels d'action sont surtout les carences en potassium et en sodium, les deux ions impliqués dans la génération des potentiels d'action.
| Carence | Excès/surdose | |
|---|---|---|
| Potassium |
|
|
| Sodium |
|
|
Les canalopathies[modifier | modifier le wikicode]
Les troubles des canaux ioniques sont regroupés sous le terme ombrelle de canalopathie. La plupart sont des maladies génétiques, ce qui se comprend aisément quand on se rappelle que les canaux ioniques sont des protéines, naturellement codées par l'ADN cellulaire. Certaines mutations peuvent ainsi donner naissance à des canaux ioniques déformés ou mal-fonctionnels, qui n'agissent pas aussi bien que les canaux ioniques "normaux". Ces canalopathies peuvent toucher aussi bien les canaux sodiques que calcique, potassiques, chlorique et bien d'autres. La plupart des canalopathies n'ont pas d'incidence cérébrale, mais touchent essentiellement le cœur et/ou les muscles. Mais les canalopathies qui touchent des canaux présents dans le cerveau ou le système nerveux ont bel et bien des manifestations neurologiques importantes. Nous n'allons aborder ici que les troubles avec des symptômes neurologiques, et allons laisser de côté des canalopathies cardiaques ou musculaires.
Certaines formes de canalopathies se manifestent par de l'épilepsie, qui survient précocement dans la vie du patient : lors de l'enfance, plus rarement de l'adolescence, rarement plus tard. Un bon exemple de canalopathie épileptique est l'épilepsie néonatale familiale bénigne, une forme rare d'épilepsie qui touche les nouveaux-nés. Cette maladie est liée à des mutations des gènes KCNQ2 et KCNQ3, qui codent les canaux perméables au potassium dépend du voltage. Les anomalies se localisent sur le chromosome numéro 20, plus rarement sur le 8ème chromosome. Du fait des mutations, mes canaux potassiques sont moins perméables que la normale, ce qui augmente la teneur en potassium dans les neurones, comparé à la normale. Le résultat est une hyperexcitabilité neuronale légère, qui se traduit par des crises épileptiques. Les convulsions apparaissent dès les premiers lors de vie et cessent à partir du quatrième mois de vie. Les nouveaux-nés atteints se développent normalement, sans séquelles neurologiques ou risque épileptique particulier. Outre l'épilepsie néonatale bénigne, d'autres formes d'épilepsies sont causées par des canalopathies. La plupart sont regroupées dans ce qui porte le nom d'épilepsie généralisée avec convulsions fébriles +. Il s'agit d'un syndrome épileptique où les patients manifestent de nombreuses formes d'épilepsies (absences, myoclonies, crises toniques cloniques, et autres). Ces formes sont causées par des défauts dans les canaux sodium, ainsi que dans certains canaux sensibles au GABA. Ces défauts proviennent de mutations dans les gènes SCN2A, SCN1A et/ou SCN1B, à quelques exceptions près.
Des canalopathies différentes peuvent être liées à des mutations distinctes d'un même gène. Par exemple, la mutation du gène nommé CACNA1A peut muter de trois manières différentes, qui donnent trois canalopathies distinctes. Ce gène code une partie d'un canal ionique au calcium dépendant du voltage, la partie nommée alpha-1 pour les intimes. Une mutation de ce gène donne naissance aux trois maladies suivantes : la migraine hémiplégique familiale de type 1, l'ataxie cérébelleuse de type 6 et l'ataxie paroxystique héréditaire. Les deux dernières se manifestent par ce qu'on appelle une ataxie, un déficit de la coordination des mouvements, d'origine neurologique. Cependant, l'âge d'apparition et la durée des symptômes varient grandement entre ces deux maladies. L'ataxie cérébelleuse de type 6 se caractérise par une ataxie qui débute à l'âge adulte, et se développe progressivement. Seul un diagnostic génétique permet de diagnostiquer à coup sûr la maladie, qui ne se différencie symptomatiquement pas du tout des autres formes d'ataxies non-génétiques. L'ataxie paroxystique héréditaire correspond à des épisodes d'ataxie qui surviennent spontanément et disparaissent en quelques minutes, quelques heures ou quelques jours. L'épisode d'ataxie est accompagné de nausées et de vertiges dans la plupart des cas, avec parfois des migraines ou d'autres manifestations neurologiques. Enfin, la migraine hémiplégique familiale de type 1 est une forme de migraine accompagnée de symptômes neurologiques divers, dont une paralysie de la moitié du corps (hémiplégie). Il faut signaler que d'autres formes de migraine hémiplégique familiale et d'ataxie cérébelleuse familiale sont causées par des mutations d'autres gènes. Par exemple, la migraine familiale hémiplégique peut être causée par des mutations des gènes CACNA1A, ATP1A2, SCN1A et 1q31. Ces mutations vont modifier la forme des canaux calcium, des pompes potassium/sodium, des canaux sodium et de quelques autres molécules.
Nous reparlerons dans quelques chapitres de certaines formes de myasthénie, une maladie caractérisée par une faiblesse musculaire persistante évoluant vers une paralysie permanente. Ces myasthénies sont, pour la plupart, caractérisée par une disparition des canaux ioniques sur la surface des muscles, sur la jonction entre neurones moteurs et muscles (dans la jonction neuromusculaire). Ce cas est particulier, comparé aux maladies précédentes, dans le sens où les canaux sont éliminés par le système immunitaire. Le sang des patients myasthéniques contient des anticorps qui attaquent les canaux ioniques neuromusculaires, ce qui fait que le muscle devient de plus en plus insensible aux stimulations neuronales. Il s'agit donc d'une maladie à la fois auto-immune et canalopathique.
Les maladies démyélinisantes[modifier | modifier le wikicode]
Certaines maladies dégradent la gaine de myéline qui entoure les axones, d'où leur nom de maladies démyélinisantes. Elles ont pour conséquence de ralentir la propagation de l'influx nerveux, si ce n'est de l’empêcher, ce qui entraîne des troubles neurologiques divers et variés : troubles de la vision, de l'audition, de la motricité, de la cognition, de la mémoire, etc. Ces troubles sont loin d'être spécifiques, d'où une difficulté de diagnostic assez marquée. On peut classer ces maladies en deux types, selon leur cause : les myélonoclasties et les leucodystrophies. Les premières sont des maladies inflammatoires déclenchées par des toxines, des infections ou des réactions auto-immunes, qui dégradent la myéline des axones. La plus connue est certainement la sclérose en plaque, secondée par la maladie de Charcot et le syndrome de Guillain-barré. Les secondes sont causées par une non-production de la myéline et sont d'origine génétique. Pour l'anecdote, il existe des cas de non-fabrication de substance blanche qui ne sont pas génétique. C’est le cas, par exemple, de la non-production de myéline induite par une carence en vitamine B12. Ces cas particuliers sont à part et ne font pas partie des leucodystrophie, même si le mécanisme est le même.
| Nom | Myélonoclastie | Leucodystrophie | Autre |
|---|---|---|---|
| Cause | Inflammatoire (auto-immune, génétique, infectieuse) | Génétique | Autre : carence nutritionnelle, traumatisme, ... |
| Mécanisme/cause | Destruction de la myéline axonale. | Non-production de la myéline. | Non-production de la myéline. |
| Exemples | Sclérose en plaque. | Leucodystrophie de Duchenne. | Déficits neurologiques de la carence en vitamine B12 |
La sclérose en plaque[modifier | modifier le wikicode]
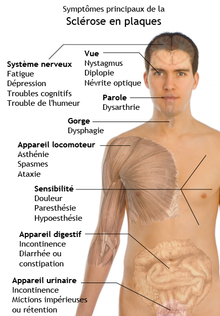
La sclérose en plaque est une myélonoclastie dont le nom est connu du grand public. Comme toutes les maladies démyélinisantes, son diagnostic est difficile, du fait de la forte variété des symptômes : n'importe que symptôme neurologique ou psychiatrique peut être présent chez un patient, même si certains symptômes sont "relativement caractéristiques". La sclérose en plaque touche le cerveau et la moelle épinière, mais épargne les gaines de myéline formées par les cellules de Schwann. À l'heure actuelle, cette maladie est considérée comme auto-immune (le système immunitaire se retourne contre des cellules saines de l'organisme). Nul ne sait, à l'heure où j'écris ces lignes, quelle est la cause de cette maladie. Il pourrait s'agir d'une réaction de l'organisme contre la myéline, ou d'une réaction face à une infection de la myéline par un virus, personne ne sait. Tout au plus les scientifiques ont-ils quelques pistes, ainsi que quelques certitudes épidémiologiques. Par exemple, on sait que les femmes sont notamment plus atteintes que les hommes et qu'il existe quelques rares cas de sclérose en plaque familiale. Heureusement, les médecins savent réduire ses symptômes avec des traitements immunosuppresseurs.
La sclérose en plaque peut se manifester de diverses manières. Dans la majorité des cas, la maladie évolue par poussées. On observe alors des épisodes de démyélinisations, qui entraînent des troubles neurologiques transitoires. Les troubles cessent partiellement après la poussée, à cause de la régénération de la myéline, mas le patient ne revient pas tout à fait à la normale : la poussée entraîne généralement l'apparition de quelques séquelles neurologiques légères, mais permanentes. Plus rarement, on observe une progression croissante et lente de troubles neurologiques, qui s'installent et se potentialisent peu à peu. À noter que les deux tendances ne sont pas incompatibles : des épisodes peuvent se surimposer sur une progression lente de la maladie. Plus rarement, des poussées épisodiques finissent par laisser la place à une dégradation lente de la maladie.
La neuromyélite optique de Devic[modifier | modifier le wikicode]
Moins connue que la sclérose en plaque, la neuromyélite optique de Devic est une maladie démyélinisante assez rare qui ne touche qu’une à deux personnes sur 100 000. Elle se manifeste par une démyélinisation du nerf optique et de certains segments de la moelle épinière. La démyélinisation cérébrale est très rare, sa présence devant systématiquement orienter le diagnostic vers une sclérose en plaques. L'évolution de la maladie ressemble à celle de la sclérose en plaques. Souvent, le patient a des épisodes de démyélinisation soudaine avec une récupération partielle entre chaque épisode. Dans d'autres cas, la maladie évolue continuellement, avec un seul épisode continu. Chaque épisode se traduit par une brutale cécité avec des paralysies diverses.
Il s'agit vraisemblablement d'une maladie auto-immune qui attaque les astrocytes du nerf optique et de la moelle épinière. La maladie serait responsable de la production d'anticorps contre les aquaporines de type 4, des molécules qui facilitent l'entrée et la sortie de l'eau dans les cellules. Comme toute maladie auto-immune, elle se soigne en diminuant la réponse immunitaire via des corticoïdes lors des crises et par des immunosuppresseurs en dehors.
















