Le noyau atomique/Version imprimable
Une version à jour et éditable de ce livre est disponible sur Wikilivres,
une bibliothèque de livres pédagogiques, à l'URL :
https://fr.wikibooks.org/wiki/Le_noyau_atomique
Introduction historique : la découverte du noyau atomique

Dans ce chapitre, nous allons voir comment la science a progressivement découvert la structure de l'atome et a découvert le noyau atomique. Le sujet en question déborde un petit peu de la simple étude du noyau atomique (nous verrons un petit peu de chimie dans ce chapitre), mais cela donnera une bonne base pour la suite du cours. Nous allons commencer notre périple au début des années 1900. À cette époque, la physique savait que la matière était composée d'atomes, mais elle ne savait pas ce qu'il y avait dedans.
L'état de la physique atomique au début du 19ème siècle
[modifier | modifier le wikicode]Dès le 19ᵉ siècle, certains scientifiques avaient l'intuition que l'atome était composé de particules plus simples, sans toutefois réussir à le prouver. L'un d'entre eux était le médecin anglais William Prout, qui émit cette hypothèse dans un article paru en 1815. Prout étudiait la masse des atomes et il fit une remarque intéressante : la masse d'un atome est proportionnelle à la masse du noyau d'hydrogène. Une conclusion naturelle de cette observation était que l'atome était composé de plusieurs atomes d'hydrogènes reliés entre eux par une force encore inconnue à l'époque. Seule l'atome d'hydrogène était une particule fondamentale, les autres atomes en étant simplement des dérivés. Mais cette hypothèse a fini par être mise en défaut suite à des mesures plus précises, ce qui réfuta l'idée de Prout. La proportionnalité entre masse atomique et masse de l'hydrogène était simplement approximative. Cette approximation a d'ailleurs été nommée règle de Prout en son honneur.
Grâce à Prout et quelques autres scientifiques, les chimistes prirent l'habitude de mesurer la masse d'un atome par rapport à la masse de l'hydrogène. Par exemple, le Carbone a une masse égale à 12 atomes d'hydrogène, l'Oxygène 8 fois, etc. Le coefficient de proportionnalité est appelé le nombre de masse, noté A. Par exemple, le nombre de masse du Carbone est de 12 (A = 12), celui de l'oxygène 8, etc. Les chimistes utilisaient aussi le nombre atomique Z, qui indique la position de l’élément chimique dans le tableau périodique de Mendeleïev. Certaines relations entre Z et A laissaient penser que le noyau n'est pas d'un seul tenant et donnent des indices sur ce qui se trouve à l'intérieur d'un atome.
- Les chimistes ont remarqué que le nombre de masse est approximativement égal au double du nombre atomique : .
- Un même élément chimique correspond à plusieurs formes de Z identique, mais de A très différents. Ces formes alternatives d'un même élément chimique, qui sont plus lourdes ou plus légères que l’élément normal, sont appelées des isotopes.
Par la suite, on découvrit le phénomène de radioactivité alpha, où un atome émet spontanément une particule dite alpha. Cette particule alpha a un nombre de masse égal à 4, soit quatre atomes d'hydrogènes et un Z égal à 2. Il s'agit donc d'Hélium, et plus précisément d'un de ses isotopes, nommé Hélium-4 (la forme la plus courante de l'Hélium). En 1911, le physicien Rutherford supposa que tous les atomes sont composés de particules alpha, donc de noyaux d'Hélium-4. La supposition de Rutherford permettait d'expliquer le fait que pour tous les atomes, les particules alpha comprises. Mais elle collait mal avec deux observations. Déjà, la moitié des atomes ont un Z impair, ce qui ne colle pas avec de l'Hélium ayant un Z pair. Ensuite, certains atomes lourds ne respectent pas la formule et ont un nombre de masse légèrement plus grand que 2 Z. Cet excès de A ne colle pas avec un atome composé de particules alpha et encore moins avec un atome composé d'hydrogène. On pourrait cependant pu sauver l'hypothèse en remplaçant les particules alpha par le noyau d'hydrogène pour qui , comme de nombreux chimistes l'avaient pensé auparavant, mais cela n'expliquait pas l'existence des isotopes et était incompatible avec l'approximation .
Les modèles de l'atome suite à la découverte de l'électron
[modifier | modifier le wikicode]La science fît un grand bond en avant suite à la découverte de l'électron, une particule chargée négativement et de faible masse. C'est alors que commença la découverte de la structure atomique, qui mena finalement à la découverte du noyau atomique. Les savants découvrirent que l'atome n'est pas une entité élémentaire, mais qu'il est composé de plusieurs particules individuelles, dont les électrons, qui s'assemblent pour former un atome. Thomson, qui avait découvert l'électron en 1903, a rapidement deviné que l'atome contient des électrons. Mais les électrons sont des particules chargées négativement, alors que les atomes sont neutres : l'atome doit contenir des charges positives pour compenser la charge électronique. Plusieurs modèles concurrents apparurent alors.
Dès 1903, Philipp Lenard supposait que les charges des électrons étaient compensées par des particules chargées positivement. Il avait établi un modèle où chaque électron était lié par des interactions électrostatiques à une particule positive. L'ensemble était neutre et il était logique que des charges opposées s'attirent au point de se lier. Mais il fallait expliquer pourquoi chaque couple électron-particule s'assemblait pour former un noyau. Les forces électrostatiques auraient pu servir à cela, mais les calculs ne collaient pas à certaines observations.
Thomson, quant à lui, supposa que les électrons sont noyés dans une sorte de gelée chargée positivement, chose qui a été décrit comme des raisins dans du pudding. Les électrons étaient, dans ce modèle, libres de se déplacer dans la gelée positive, leur trajectoire étant grossièrement elliptique, mais très irrégulière. Les électrons ont peu de chances de quitter l'atome, du moins, sans qu'on leur apporte d'énergie. Si un électron s'éloigne trop du centre, la répartition des charges se déséquilibre et fait naître une charge positive au centre de l'atome. La charge induite attire alors l’électron fugueur vers le centre de l'atome, ce qui l'empêche de fuir. Thomson compris rapidement que la trajectoire des électrons avait un lien avec le phénomène des raies atomiques, mais ne put le démontrer formellement. Il fallut attendre le modèle de Bohr pour que ce lien devienne plus clair. Mais laissons cela à un cours de chimie.
En 1904, le scientifique japonais Hantarō Nagaoka proposa un modèle alternatif à celui de Thomson. Il considérait que celui-ci était incorrect, pour diverses raisons, la principale étant que des charges opposées en peuvent pas s'interpénétrer (ce qui est le cas dans le modèle de Thomson). Son modèle de l'atome était basé sur le fait que la charge positive était localisée au centre de l'atome, dans un petit espace : le noyau atomique. Les électrons tournaient autour du noyau atomique, sur des orbites elliptiques ou circulaires. La ressemblance de cette configuration fait que sa théorie a été appelée le modèle planétaire de l'atome. Il supposait que le noyau était très massif comparé aux électrons, afin de garantir la stabilité de l'ensemble. Les électrons étaient maintenus sur leurs orbites par les forces électrostatiques, à savoir l'attraction du noyau positif. Ces deux prédictions furent confirmées par la suite, mais divers éléments plus précis du modèle furent cependant réfutés par la suite. Le modèle exact était correct dans les grandes lignes, mais ses détails et sa formulation mathématique avaient quelques soucis sur lesquels nous ne nous attarderons pas.
 |
 |
 |
La découverte du noyau : l'expérience de Rutherford-Geiger-Mardsen
[modifier | modifier le wikicode]L'existence du noyau postulé par Hantarō Nagaoka fût confirmée en 1909 par l'expérience de Rutherford-Geiger-Marsden., réalisée par deux expérimentateurs, Hans Geiger et Ernest Marsden, sous la direction d'Ernest Rutherford. Cette expérience visait à étudier la répartition des constituants de l'atome en bombardant une feuille d'or par un faisceau de particules alpha. Elles auraient alors dû traverser l'atome sans interagir avec les électrons et ses autres constituants. Pour vérifier le comportement des particules alpha, un écran sensible était placé derrière la feuille d'or. Quand une particule alpha touchait l'écran, un point lumineux s'affichait sur celui-ci.
Les scientifiques s'attendaient à ce que la feuille soit globalement transparente aux particules alpha, ne laissant qu'un faisceau très fin sur l'écran. Mais ils virent que le faisceau se dispersait, avec des points étalés sur de grandes distances. Les particules alpha rebondissaient sur l'atome, pourtant presque vide. Les expérimentateurs purent montrer que 0,01 % des particules étaient déviées, les 99,99 % autres traversant la feuille d'or sans encombre. Les angles de déviation étaient assez variés et certaines particules étaient même renvoyées en arrière. Rutherford décrit ce résultat en ces termes : « tout se passe comme si vous bombardiez une feuille de papier avec un obus de 15 pouces, que le projectile rebondisse vers vous et vous touche ». Il devait y avoir quelque chose dans l'atome sur lequel les particules rebondissaient, mais quoi ?


Le problème principal était que certaines particules rebondissaient avec un angle de plus de 90°. Les règles de la mécanique, appliquées aux collisions entre deux corps, nous disent que cela n'est possible que si l'impacteur est plus léger que le corps impacté. La seule explication au rebond des particules alpha est donc qu'elles cognent sur quelque chose de plus lourd qu'elles. Mais les électrons sont bien plus légers que les particules alpha, ce qui fait qu'il doit y avoir autre chose dans l'atome... Le faible nombre de particules renvoyées donne quelques contraintes sur la taille de cet autre chose : il doit être très petit. Plus cet objet massif est gros, plus les particules alpha ont de chances de cogner dessus et plus il devrait y en avoir qui rebondissent vers l'arrière. Le faible nombre de particules alpha renvoyées implique que c'est un petit objet, à peine un pourcent du volume de l'atome, voir moins. En clair : l'atome contient un petit objet très petit mais très massif, vraisemblablement de charge positive.
Rutherford établi alors une formule qui relie le pourcentage de particules qui rebondissent avec un angle de rebond . Nous la démontrerons dans le chapitre sur les diffusions nucléaires et l'étudierons plus en détail. Pour le moment, contentons-nous de dire qu'elle suppose ceci : la particule alpha ne rebondit pas vraiment sur le noyau, mais est en réalité repoussée par répulsion électrostatique. Cette répulsion dévie la particule et peut même la renvoyer si elle arrive avec la bonne trajectoire. La formule de Rutherford collait parfaitement avec les résultats de ses assistants, sauf pour des valeurs d'angle particulièrement élevées. Ils ne le savaient pas à l'époque, mais ces déviations entre formule de Rutherford et résultats permettent d'étudier la structure interne du noyau. Mais revenons à nos moutons... Rutherford utilisa cette formule pour calculer la taille du noyau et l'appliqua sur les expériences de ses assistants. Il put ainsi déterminer la taille du noyau atomique, qui se révéla extrêmement petite. Le noyau ne fait que 1% du volume de l'atome, alors qu'il concentre la majorité de sa masse. Environ 99% de l'atome est intégralement composé de vide, électrons et noyau compris.
La découverte du proton
[modifier | modifier le wikicode]Après la découverte du noyau, les physiciens ont établi que le noyau était chargé positivement et de petite taille. Sa charge est de plus égale à la charge des électrons, mais de signe contraire. Certains scientifiques supposèrent que le noyau était lui-même composé de particules élémentaires, chargées positivement et de même masse que le noyau d'hydrogène. Parmi ces raisons, on peut citer la règle de Prout, mais celle-ci est loin d'être la seule. Antonius van den Broek a supposé que la place de chaque élément dans la classification périodique est égale à la charge de son noyau, ce qui est confirmé par les expériences d'Henry Moseley en 1913.
La découverte du proton
[modifier | modifier le wikicode]En 1919, Rutherford fit une nouvelle expérience qui lui permit de découvrir le premier composant du noyau. Il voulait vérifier les résultats d'une expérience de Mardsen, qui avait observé l'émission d'hydrogène lors de la désintégration du Radium. Mardsen avait observé l'émission de particules alpha d'un morceau de radon dans une chambre remplie d'Hydrogène gazeux. Les particules alpha émises entraient en collision avec des atomes d'Hydrogène, les envoyant sur un écran scintillant (comme dans l'expérience de Rutherford, sauf que l'écran était sensible aux atomes d'Hydrogène). Il observait bien des points scintillants quand la chambre était remplie d'Hydrogène, preuve que le dispositif marchait parfaitement. Mais, quand il vida la chambre et la remplit d'air, il vit que des points scintillants apparaissaient toujours, bien que moins souvent. Il en déduit, on sait aujourd'hui à tort, que le radon émettait de l'Hydrogène.
Pour en avoir le cœur net, Rutherford répliqua l'expérience en remplaçant l'Hydrogène par du dioxyde de Carbone, de l'Oxygène et de l'air sec. Seul l'air sec permettait d'observer ce phénomène, ce qui fit penser à Rutherford qu'il devait être lié à un gaz présent dans l'air qui n'est ni CO2 ni O2 : l'Azote. Pour le vérifier, Ruthetford bombarda des noyaux d'Azote avec des particules alpha très énergétiques. Il observa alors les scintillations, prouvant son hypothèse. Pour résumer, Rutherford pensait que les collisions entre particules alpha et Azote arrachaient des noyaux d'Hydrogène à l'Azote. Ce fût confirmé par des expériences dans des chambres à brouillards, qui permettent de voir les trajectoires des particules, qui donnaient des résultats compatibles avec l'hypothèse de Rutherford. Cette expérience montra que les noyaux peuvent se casser, suite à un choc ou spontanément, en émettant un noyau d'Hydrogène.
Les modèles du noyau avec électrons intranucléaires
[modifier | modifier le wikicode]
Preuve était faite que les noyaux contiennent des noyaux d'Hydrogène, qui sont composés d'une unique particule encore inconnue à l'époque : le proton. Les protons sont des particules chargées électriquement. Leur charge est positive, de même valeur absolue que celle de l’électron. Il a une masse de kg, ce qui est presque égal à 1836,15 fois celle de l’électron. La masse du noyau semble approximativement proportionnelle à la masse du proton. L'expérience de Rutherford montrait que le noyau contenait des protons et il était naturel de supposer qu'il était composé uniquement de protons. C'est d'ailleurs à la suite de ces découvertes que Rutherford proposa, en 1920, un modèle de l'atome similaire au modèle de Nagaoka (qu'il cite dans son article), mais sans ses défauts.
Mais cette hypothèse a un défaut : elle ne rend pas compte de la charge du noyau. En effet, si on suppose que le noyau atomique est composé de protons, alors la charge calculée ne correspond pas. Si on mesure la masse en unité d'atomes d'hydrogène et la charge électrique, il y a un facteur 2 entre ces deux valeurs : il doit y avoir deux fois plus de protons que d’électrons du point de vue de la masse, mais autant de protons que d’électrons du point de vue de la charge. Prenons l'exemple de l'atome de carbone 12, qui contient 6 électrons : son noyau a une charge de 6 (ce qui correspond à 6 protons), mais sa masse est de 12 fois celle du proton. Et ce problème se rencontre pour tous les noyaux, excepté pour l'hydrogène (et plus précisément pour son isotope appelé le protium). Pour résoudre ce problème, les physiciens ont postulé que le noyau contenait des électrons qui compensaient la charge de la moitié des protons. Cette théorie des électrons nucléaires avait cependant de nombreux problèmes techniques et expliquait mal certaines données expérimentales.
La découverte du neutron
[modifier | modifier le wikicode]La découverte du neutron en 1932 par Chadwick changea la donne. Les scientifiques ont rapidement compris que le noyau contenait à la fois des protons et des neutrons, suite à diverses observations qui montrèrent que le neutron est un constituant du noyau. Le neutron a une charge électrique nulle, contrairement au proton et à l’électron. Sa masse est très légèrement supérieure à celle du proton (un neutron est 1,0014 fois plus lourd que le proton) et vaut kg.
Les modèles ultérieurs de l'atome
[modifier | modifier le wikicode]Par la suite, les physiciens ont inventé d'autres théories de la structure atomique, mais celles-ci ne nous intéressent pas dans ce cours. Le fait est qu'elles se préoccupent presque uniquement du cortège électronique, à savoir l'ensemble des électrons d'un atome. Les plus connues sont le modèle de Bohr et de Schrödinger : elles se basent sur la physique quantique, ce qui les rend assez difficiles à comprendre pour le profane. Ceux qui veulent en savoir plus peuvent lire le Wikilivre suivant, qui détaille les différents modèles de l'atome. Mais nous n'en aurons pas vraiment l'utilité dans ce qui suit.
Les nucléons : protons et neutrons, quarks et gluons
Comme on l'a vu dans le chapitre précédent, le noyau atomique est composé de particules plus élémentaires : des protons et des neutrons. Protons et neutrons sont souvent appelés des nucléons (terme indiquant qu'ils proviennent du noyau - nucleus). Les nucléons possèdent diverses propriétés, comme toutes les autres particules : ils ont une masse, une charge électrique (positive pour les protons, nulle pour les neutrons), une taille, une durée de vie (certaines particules peuvent se désintégrer au bout d'un certain temps), et quelques autres. Les nucléons sont les particules qui composent les noyaux atomiques et se résument aux protons et aux neutrons. Les protons et neutrons ne sont pas des particules élémentaires, ce qui veut dire qu'ils sont eux-mêmes composés de particules plus petites : les quarks.
Les quarks
[modifier | modifier le wikicode]Les nucléons sont eux-mêmes composés de particules plus élémentaires : les quarks. Les quarks ne sont pas eux-mêmes composés de particules plus petites, du moins dans l'état actuel de nos connaissances : on dit que ce sont de particules élémentaires.
Les saveurs des quarks
[modifier | modifier le wikicode]Il existe six sortes de quarks, appelées quarks up, down, strange, charm, bottom et top. Chaque type de quark est appelé une saveur, terme que nous réutiliserons quand nous parlerons de la désintégration bêta. Ils se différencient par leur charge électrique, ainsi que par d'autres propriétés physiques liées à la physique quantique (saveur, charge de couleur, ...). La charge électrique des quarks est une fraction de la charge électrique élémentaire (qui est, pour rappel, la charge de l'électron) : elle vaut soit le tiers, soit les deux tiers de e.
| Particule de charge fractionnaire −1/3 | Particule de charge fractionnaire +2/3 |
|---|---|
| Down (Bas) | Up (Haut) |
| Strange (Étrange) | Charm (Charme) |
| Bottom (dessous) | Top (dessus) |
 |
 |
 |
 |
 |
 |
À noter que chaque quark est associé à un anti-quark (Pour rappel, les anti-particules sont à opposer aux particules normales : chaque particule est associée à une anti-particule dont les propriétés sont strictement inverses, à l'exception de la masse et du spin).
La conservation du nombre baryonique
[modifier | modifier le wikicode]Les quarks ne peuvent pas être détruits ou annihilés, sauf en interagissant avec des anti-quarks. Il est possible qu'un quark fusionnent avec un anti-quark, ce qui donne généralement deux photons et beaucoup d'énergie. De même, il est possible de créer une paire quark/anti-quark en fournissant assez d'énergie. Mais il n'est pas possible de détruire ou de créer un quark isolé (pareil pour les anti-quarks). La création/destruction d'un quark demande un anti-quark qui est lui aussi créé/détruit en même temps que le quark initial.
Il y a donc une loi de conservation qui dit que lors d'une réaction nucléaire ou d'une interaction entre particules, la différence (nombre de quark - nombre d'anti-quark) reste constante. S'il y a un excès de quarks au début d'une réaction nucléaire, alors cet excès sera conservé par la réaction nucléaire. S'il y égalité ou défaut, pareil. Cela s'appelle la conservation du nombre baryonique, qui est définit comme suit :
- , où est le nombre de quarks et est le nombre d'antiquarks.
La division par trois a une origine historique, mais n'a pas de sens physique.
L'interaction faible : les désintégrations des quarks
[modifier | modifier le wikicode]Les quarks sont sensibles à plusieurs interactions, plusieurs forces. En tout, il existe quatre forces fondamentales de la nature. Les deux plus connues sont la gravité et l'électromagnétisme, qui agissent sur toute forme de matière, ou presque. Mais les quarks sont sensibles à deux forces qui leur sont spécifiques : l'interaction forte et l'interaction faible. Nous réservons l'interaction forte pour la fin de chapitre, mais nous devons parler de la l'interaction faible ici.
L'interaction faible n'intervient que dans les désintégrations nucléaires et quelques autres phénomènes mineurs. Les particules qui interagissent avec l'interaction faible sont nombreuses, mais le cas le plus important pour ce qui nous intéresse est celui des quarks. Précisons cependant que d'autres particules que les quarks sont sensibles à l'interaction faible.
L'interaction faible a le pouvoir de changer la saveur des quarks. Par exemple, on peut transformer un quark up en quark down (ou inversement). Le diagramme ci-dessous montre toutes les désintégrations possibles d'un quark vers un autre. On voit que les quarks sont répartis en deux classes : les down, strange et bottom d'un côté et up, charm et top de l'autre. Un quark peut se transformer en tous les membres de l'autre classe, mais ne peut pas se désintégrer en un quark de la même classe que lui. Vous remarquerez que ces deux classes se caractérisent par la charge électrique du quark : ceux de charge 1/3 d'un côté, ceux de charge 2/3 de l'autre. Le quark de départ et d'arrivée ne peuvent pas avoir la même charge électrique.

Vous avez peut-être pensé que de telles désintégrations violent la conservation de la charge. Par exemple, si on prend la désintégration d'un quark up en quark down, les deux n'ont ni la même masse, ni la même charge, et la différence entre les deux doit être compensée d'une manière ou d'une autre. Pour cela, lors de telles désintégrations, des particules sont émises ou absorbées, afin de conserver la charge, la masse et quelques autres propriétés quantiques.
Les particules en question sont les bosons électrofaibles, à savoir les bosons , et . Les bosons W+ et W- sont chargés électriquement, alors que les bosons Z ne le sont pas. Cela explique le nom de ces bosons : Boson Zero (sous-entendu, zéro charge), W+ chargé positivement et W- chargé négativement. Les bosons W+ et W- sont chacun l'anti-particule de l'autre, alors que le boson Z est sa propre anti-particule. Les bosons Z ne sont pas vraiment impliqués dans les désintégrations de Quarks, à l'inverse des bosons W+/-. Par exemple, la transformation d'un quarks up en down entraîne l'émission d'un boson .
 |
 |
Les désintégrations de quarks ne sont pas équiprobables et que certaines ont plus de chances de survenir que les autres. Le tableau ci-dessous dit quelles sont les désintégrations les plus fréquentes et celles qui sont au contraire peu fréquentes, en utilisant la couleur des flèches. De plus, il indique quel boson est émis lors des désintégrations. Pour l'expliquer simplement, la transformation d'un quark Top, Charm, Up en un autre se fait en émettant un boson W+. Les désintégrations inverses se font en émettant un boson W-.
La logique derrière ces désintégrations est assez simple : elles font perdre de l'énergie aux quarks, en émettent un boson W+/-. C'est là une chose commune en physique : beaucoup de systèmes tendent à évoluer vers leur état d'énergie minimale, le plus stable. Le quark Top, le plus énergétique/massif de tous, se désintègre rapidement en un autre Quark, mais que l'inverse n'est pas possible. Ils sont donc très rares dans la nature. Les autres quarks se désintègrent aussi assez rapidement bien que pas aussi vite que le quark Top. Si on suit toutes les désintégrations possibles, les quarks finissent rapidement par se désintégrer en quarks Up et Down, les deux les plus stables en raison de leur faible énergie. Le quark Up est le plus stable des deux, car il a l'énergie la plus faible.

Il existe un équivalent pour l'interaction faible de ce qu'est la charge électrique pour l'électromagnétisme ou la masse pour la gravité. Cet équivalent s'appelle l'isospin faible et il prend des valeurs assez précises : ou pour les fermions, et pour les bosons. L'isospin faible est une quantité conservée par les réactions faibles, de la même manière que la charge et la masse sont des grandeurs conservées. Du moins, c'est le cas dans la quasi-totalité des cas, sauf des exceptions qui font intervenir le fameux boson de Higgs, mais c'est une autre histoire...
Les hadrons : mésons et baryons
[modifier | modifier le wikicode]Les quarks ont naturellement tendance à s'assembler pour former des particules plus grosses, qui sont appelées des hadrons. Il en existe plusieurs types, les deux principaux étant les mésons et les baryons :
- les mésons, formés d'un quark et de son anti-quark ;
- les baryons, formés par l'association de trois quarks.

Avec six quarks, on peut penser que les combinaisons sont innombrables. Et elles le sont ! Cependant, il faut signaler que le Quark Top ne se retrouve jamais dans un hadron. La raison est simple : sa durée de vie est de secondes. C'est très peu, tellement que les quarks n'ont pas le temps de s'assembler avec d'autres pour former un hadron : ils se désintègrent avant. Il ne reste donc que 5 quarks pour former les hadrons. Et la plupart des hadrons stables contient des quark Up et Down, les deux plus stables.
Dans le reste du cours, nous allons surtout nous intéresser à deux hadrons particuliers : le proton et le neutron. Ils sont formés à partir de quarks Up et Down. Le proton est formé de deux quarks Up et d'un quark Down, alors que c'est l'inverse pour le neutron.
 |
 |
Les propriétés des hadrons
[modifier | modifier le wikicode]Les propriétés des hadrons sont grossièrement celles des quarks qui les composent. Par exemple, la charge électrique d'un hadron/nucléon est la somme des charges de ses quarks. La masse fait cependant exception, mais il m'est impossible d'expliquer cela facilement. En tout cas, sachez que près de 1% de la masse d'un proton/neutron s'explique par la masse des quarks qui le constitue !
Une autre propriété des hadrons est leur durée de vie. Par durée de vie, on veut dire le temps moyen avant qu'une particule se désintègre, à savoir avant qu'elle se transforme spontanément en une ou plusieurs particules. Et pour les hadrons, ce temps est faible. Les hadrons sont presque tous instables et se désintègrent rapidement en d'autres particules. La plupart une une durée de vie moyenne de quelques microsecondes, voire moins. Cette instabilité ne vaut cependant que pour des hadrons isolés. Quand les hadrons sont regroupés en noyaux atomiques, ou en agrégats similaires, leur durée de vie est bien plus grande ! Ils sont instables seuls, mais très stables isolés, un comportement assez particulier. Il y a cependant une exception : le proton, que nous verrons plus tard, est une particule très stable à l'état isolé.
Les hadrons sont des particules dont la masse est très faible, de l'ordre du milliardième de milliardième de milliardième de grammes ! Autant dire que travailler avec les unités usuelles (le gramme, le kilogramme) n'est pas aisé quand on parle des nucléons. Aussi les physiciens utilisent une autre unité : l'électron-volt. Cette unité se base sur l'équivalence entre masse et énergie découverte par Einstein, à savoir la fameuse équation . L'électron-volt correspond à l'énergie que possède un électron quand il est soumis à une tension de 1 volt, normalisée en unité de masse (à savoir, cette énergie divisée par c²).

Les nucléons possèdent une propriété particulière, qui s'appelle le spin. Le spin est représenté par un vecteur qui ne peut prendre que deux directions différentes (vers le haut ou vers le bas). Expliquer ce qu'est le spin est toujours compliqué, sachant que c'est une propriété sans équivalent en physique classique. Pour simplifier fortement et quitte à dire des choses fausses, le spin est lié au fait que les particules tournent sur elles-mêmes. Avec cette interprétation, le vecteur du spin n'est autre que l'axe de rotation de la particule sur elle-même et sa norme est la vitesse de rotation. En clair, le spin est le moment cinétique d'une particule. Le spin des hadrons vient du fait que les quarks en ont un : ils tournent sur eux-mêmes. Le spin d'un hadron est la somme des spins des quarks qui le composent.

Le proton et le neutron
[modifier | modifier le wikicode]Pour rappel, le proton est formé de deux quarks Up et d'un quark Down, alors que c'est l'inverse pour le neutron. Il existe aussi un anti-proton et un anti-neutron, qui sont composés d'anti-quarks.
| Nucléons |  |
 |
|---|---|---|
| Anti-nucléons |  |
 |
Dans ce qui suit, je vais détailler quelques propriétés des nucléons.
Rayon : Le rayon du proton est encore inconnu : certaines mesures donnent la valeur de 0,84184 femtomètres alors que les mesures basées sur des collisions avec des électrons donnent une valeur comprise entre 0,875 et 0,88 fm. La raison de cette différence n'est pas encore connue à ce jour. Le rayon du neutron est approximativement le même que celui du proton.
Masse : Les nucléons ont une masse proche d'environ 940 . La masse du neutron et du proton ne sont pas exactement égales : 938,272 millions d'électron-volt pour le proton et 939,5654 millions pour le neutron. Le neutron est donc légèrement plus massif que le proton, mais cette différence est anecdotique : un neutron est aussi massif que 1,0014 protons. Pour beaucoup d'applications, on peut supposer que proton et neutron ont la même masse. En kilogrammes, cela fait kg pour le proton et kg pour le neutron. Un proton a une masse approximativement égale à 1 836,15 fois celle de l’électron.
Spin : Pour les protons et les neutrons, le spin vaut . Cela fait donc deux possibilités pour le spin d'un nucléon : (nucléon orienté vers le haut) et (nucléon orienté vers le bas).
Charge électrique : Proton et neutron n'ont pas la même charge électrique : là où le neutron est neutre (d'où son nom), la charge du proton est positive et égale en magnitude mais opposée en signe à celle de l’électron, négative. On peut s'en rendre compte en faisant la somme des charges électriques des quarks.
Polarisabilité électrique : Protons et neutrons peuvent se polariser électriquement, à savoir qu'on observe l'apparition d'un pôle positif et d'un pôle négatif quand on les soumet à un champ électrique. Ce comportement est lié au fait que les quarks sont chargés. Quand on les soumet à un champ électrique, la répartition des charges est modifiée : les quarks positifs sont attirés par la source du champ, alors que les quarks négatifs sont repoussés (ou l'inverse selon la polarité du champ). Les quarks positifs s'accumulent d'un côté alors que les négatifs s'empilent de l'autre, ce qui donne naissance à un pôle positif et un pôle négatif.
Moment magnétique : Les nucléons se comportent comme de minuscules aimants et ont un pôle nord et un pôle sud : on dit qu'ils ont un moment magnétique dipolaire. Pour le proton, on peut l'expliquer par un fait simple : le proton est chargé et a un spin non-nul (en clair, il tourne sur lui-même). Or, toute charge électrique qui tourne sur elle-même forme une boucle de courant, et les lois de l'électromagnétisme nous disent que cette boucle génère un champ magnétique. La logique est différente pour le neutron, qui est électriquement neutre. En réalité, cela vient du fait que les nucléons sont composés de particules chargées qui ont un spin. Le champ magnétique des nucléons est en réalité la somme des champs créés par chaque particule dans le proton ou le neutron. Le champ magnétique produit par les nucléons est très petit, mais il est exploité dans certaines techniques d'imagerie médicale (l'IRM). La valeur du moment magnétique se calcule à partir du spin avec la formule qui suit :
- , avec m la masse de la particule, q sa charge et g un coefficient appelé facteur de Landé, qui vaut pour le proton, et pour le neutron. Au passage, le facteur est appelé le facteur gyromagnétique.

Durée de vie : Les protons ont une durée de vie qui est supposée infinie, personne n'ayant observé de désintégration de protons. Le modèle standard (la théorie qui résume le mieux la physique des particules) dit que le proton est parfaitement stable et qu'il ne peut pas se désintégrer. Mais des théories physiques très élaborées prédisent que le proton se désintégrerait en plusieurs millions de milliards de milliards de milliards d'années ( années environ).
Pour le neutron, la situation est celle habituelle pour les hadrons : les neutrons sont stables dans les noyaux atomiques, mais se désintègrent spontanément en dehors en moins de 15 minutes. Cette désintégration donne un proton et un électron, secondés par d'autres particules. Nous reparlerons de cette désintégration dans quelques chapitres.
| Proton | Neutron | |
|---|---|---|
| Charge électrique | + e | 0 |
| Masse | 938,272 MeV (méga électron-volt). | 939,5654 MeV (méga électron-volt). |
| Durée de vie | Infinie | 880,3 secondes (environ 15 minutes) |
| Spin | ||
| Moment magnétique | 2,792847351 μN | −1,9130427 μN |
Les hadrons exotiques
[modifier | modifier le wikicode]La définition exacte des mésons et baryons est en fait la suivante : les baryons ont un nombre impairs de quarks/anti-quarks, les mésons en ont un nombre pairs. Mais les définitions précédentes sont souvent utilisées par abus de langage. Les deux définitions ne sont pas identiques. Récemment, on a découvert des hadrons exotiques, qui collent avec la dernière définition, mais pas la première. De tels hadrons sont appelés des hadrons exotiques.
Par exemple, les baryons sont définis comme ayant un nombre impair de quarks. Il ne peut pas exister de hadron avec un seul quark, pour une raison que nous verrons plus loin. Les baryons usuels ont trois quarks. Mais il existe des baryons exotiques avec 5 quarks, qui portent le nom de pentaquarks. Ils sont composés quatre quarks et un anti-quark, les autres combinaisons n'étant pas possibles. La raison à cela sera expliquée plus bas. Pour le moment seuls quatre pentaquarks ont été observés avec "certitude" (pour autant qu'on ait des certitudes en sciences), dans les expériences du LHC. Les baryons avec 7, 9 ou plus quarks, existent en théorie, mais les accélérateurs de particules n'ont pas l'énergie suffisante pour les fabriquer.
Pour les mésons, ils ont tous autant de quarks que d'anti-quarks. La raison sera expliquée dans la section suivante. Les mésons usuels ont un quark et un anti-quark, pas plus. Mais là encore, il existe des mésons exotiques qui en ont plus. Les plus connus sont les tétraquarks, avec deux quarks et deux anti-quarks. Il existerait des mésons avec 6 particules : 3 quarks et 3 anti-quarks.
L'hadronisation et l'interaction forte
[modifier | modifier le wikicode]Les quarks sont sensibles à une interaction appelée interaction forte, qui fait que les quarks s'attirent ou se repoussent. C'est grâce à elle que les quarks et anti-quarks s'assemblent pour former des hadrons, ce qui s'appelle l'hadronisation. Il ne s'agit pas d'une interaction électrique, magnétique ou gravitaire, mais d'une interaction séparée, spécifique aux quarks et à quelques autres particules composées de quarks.
La charge de couleur
[modifier | modifier le wikicode]L'interaction forte est liée à une propriété qu'ont les quarks, qui agit comme un équivalent de ce qu'est la masse pour la gravité ou la charge électrique pour l'électromagnétisme. Par analogie avec l’électromagnétisme, cette propriété s'appelle la charge de couleur. Mais les ressemblances s’arrêtent là et il existe de nombreuses différences entre charge électrique et charge de couleur. Par exemple, la charge de couleur ne peut prendre que trois valeurs, là où la charge électrique peut prendre n'importe quel multiple de la charge électrique élémentaire e, et où la masse peut prendre toute valeur positive ou nulle.
Les trois valeurs de la charge de couleur sont appelées respectivement : rouge, vert et bleu. Les anti-quarks ont quant à eux une anti-couleur, qui peut prendre les trois valeurs anti-rouge, anti-vert et anti-bleu.
Si on a utilisé des noms de couleur pour la charge de couleur, c'est car les particules formées de quarks et d'anti-quarks ont elles aussi une couleur, qui est la "somme" des couleurs de chaque quark/anti-quark. Et les règles de cette somme ressemblent à l'addition des couleurs primaires rouge, vert et bleu. Par exemple, un hadron qui contient un quark rouge, un autre vert et un autre bleu, aura sa couleur blanche. De même, dans le cas hypothétique où je combine un quark bleu et un quark rouge, j'aurais du violet. En combinant une particule verte avec du rouge, j'aurais une couleur jaune, etc. Et ainsi de suite, le tout, donnant les résultats illustrés ci-dessous. On voit que les mélanges obtenus sont analogues aux mélanges des couleurs primaires.
 |
 |
 |
La propriété de confinement
[modifier | modifier le wikicode]Quand des quarks s'assemblent pour former des particules, la couleur de la particule obtenue est toujours blanche. Si on prend l'exemple d'un méson, le quark a une couleur et l'anti-quark l'anti-couleur associée, ce qui donne du blanc. Une couleur est annulée par l'addition de son anti-couleur. Il est impossible de trouver des particules colorées dans la nature, sans qu'elles fassent partie de particules composites de couleur blanche. En clair, on ne peut pas trouver de quark isolé, raison pour laquelle cette propriété s'appelle la propriété de confinement. Elle est responsable de la conservation du nombre baryonique : toute interaction entre hadrons conserve la somme des nombres baryoniques des hadrons qui interagissent.
Le confinement explique pourquoi les mésons ont autant de quarks que d'anti-quarks : pour chaque quark, il faut annuler cette couleur pour obtenir du blanc. Dans le cas d'un méson avec un nombre pair de particule, ce n'est possible que si chaque quark est combiné à son anti-quark qui porte son anti-couleur.

Si on essaye d'annuler la couleur d'un quark avec deux autres quarks, on se retrouve alors dans le cas des baryons usuels. La solution à trois quarks de couleurs différentes donne un baryon usuel. Pour les pentaquarks, la solution est de prendre un baryon usuel, et d'ajouter une paire quark-anti-quark. C'est la raison pour laquelle les pentaquarks sont toujours composés de 4 quarks et un anti-quark. A ce propos, on ne sait pas très bien si la structure interne d'un pentaquark est composée de 5 particules qui interagissent fortement entre elles, ou bien d'un baryon à 3 quarks qui interagit faiblement avec un méson.
 |
 |
La force forte sature avec la distance, au lieu de diminuer
[modifier | modifier le wikicode]La différence principale avec les autres forces est que la force forte est d'autant plus importante que la distance est grande. Ce n'est pas le cas avec les autres forces : la gravité et l'électromagnétisme diminuent avec la distance, et plus précisément avec le carré de la distance. Une autre manière de le dire fait intervenir le potentiel et non la force. Une masse ou une charge électrique génère autour d'elle un potentiel qui varie linéairement et la force obtenue s'obtient en dérivant ce potentiel par rapport à la distance, ce qui donne :
- ,
Mais pour la force forte, le potentiel autour d'un Quark ressemble à ceci :
En prenant la dérivée, on trouve :
Le terme en 1/R^2 dans le terme de droite ressemble à celui de la gravité et de l'électromagnétisme. Par contre, le terme le plus à droite signifie que la force forte sature au-delà d'une certaine distance et devient constante. C'est un comportement assez inédit, qui n'est observé que pour l'interaction forte. C'est d'ailleurs ce comportement qui est à l'origine de la propriété de confinement des quarks.
Plus haut, nous avions dit que la masse d'un hadron n'est pas égale à la somme des masse de ses quarks/anti-quarks. La raison à cela est que l'interaction forte ajoute de la masse aux hadrons. Le résultat est assez impressionnant : près de 99% de la masse d'un proton ou d'un neutron provient de l'interaction forte seule !
Les gluons
[modifier | modifier le wikicode]Il faut noter que les quarks et anti-quarks peuvent s'échanger leur couleur au cours du temps. Il est ainsi parfaitement possible qu'un quark passe de la couleur rouge à la couleur verte, tant que le hadron reste de couleur blanche. Un quark peut ainsi prendre toutes les couleurs et anti-couleurs possibles, tant qu'il échange sa couleur avec celle d'un autre quark/anti-quark. Cet échange est ce qui caractérise l'interaction forte, c'est lui qui attire les quarks ensemble et les force à s'assembler en hadrons. L'échange des couleurs se fait par des particules transporteurs appelées gluons. Les gluons sont des particules non-chargées électriquement, qui possèdent ne pas de masse ! Ce sont les seules particules connues, avec le photon, à être de masse nulle !
Pour simplifier, les gluons portent à la fois une couleur et une anti-couleur (on verra dans quelques paragraphes que c'est plus compliqué, mais passons). Les gluons interagissent avec les quarks et leur donnant la paire couleur/anti-couleur qu'ils portent : un gluon bleu/anti-rouge absorbé par un quark rouge va le transformer en quark bleu ; ou encore un quark vert pourra émettre un gluon vert/anti-rouge en devenant rouge. De même, les gluons naissent quand un quark perd sa couleur : il émet alors un gluon qui contient la couleur perdue, sous la forme d'une paire couleur/anti-couleur.
 |
 |
Fait important, les gluons observés dans la nature peuvent être vus comme un mélange de plusieurs gluons purs, simples. C'est une propriété de la mécanique quantique assez étrange et difficile à comprendre, appelée le principe de superposition, qui fait qu'une particule peut être décrit comme une moyenne pondérée de deux particules pures. Dans le cas des gluons, les gluons dits purs portent à la fois une couleur et une anti-couleur. Si on compte les combinaisons couleur/anti-couleur possibles, cela fait neufs possibilités théoriques différentes, qui sont les suivantes :
- , avec la couleur rouge, le vert et le bleu, l'anti-rouge, l'anti-vert et l'anti-bleu.
| Couleur/anti-couleur | Anti-rouge | Anti-vert | Anti-bleu |
|---|---|---|---|
| Rouge | |||
| Vert | |||
| Bleu |
Ces gluons purs peuvent former des combinaisons, qui sont elles-mêmes des gluons. Par exemple, la combinaison est la moyenne d'un gluon et d'un gluon . Et il existe bien d'autres combinaisons, du type , , et j'en passe. Chaque combinaison forme un gluon impur, formé par le mélange de deux gluons purs.
Là où les choses deviennent plus intéressantes, c'est quand on analyse la combinaison suivante :
Cela devrait vous rappelez le mélange des couleurs primaire : du rouge, mélangé à du vert du bleu donne du blanc (la couleur neutre, qui vaut ici zéro). On peut reformuler l'équation précédente de trois manières différentes, qui donnent les trois équations suivantes :
La conséquence, c'est qu'une des combinaisons pures ne l'est pas vraiment. Mais difficile de dire laquelle, si tant est qu'on puisse dire avec certitude qu'il y en a une qui soit vraiment impure. Disons pour simplifier que si on prend deux combinaisons et qu'on décide qu'elles sont pures, alors la troisième est impure. Et ce peu importe le choix des deux combinaisons pures. Ce qui fait que l'on peut dire qu'une des combinaisons est redondante, impure. Mais le choix de celle à éliminer est arbitraire !
Pour résumer, parmi les neufs gluons purs théoriques, il y a une redondance cachée qui fait qu'il n'y a en réalité que huit gluons purs. Seuls les six gluons suivants ne sont pas concernés par cette redondance :
- , , , , ,
Par contre, les trois gluons suivants sont concernés et on peut éliminer arbitrairement l'un d'entre eux :
- , ou
C'est ce qui explique pourquoi les physiciens ont coutume de dire qu'il n'existe que huit gluons, en raison de cette redondance, et non neuf.
Le noyau atomique : propriétés, constituants, description
Le noyau possède une masse, un rayon, une forme précise, une charge électrique, et ainsi de suite. Mais un noyau de Thorium et un noyau de Sodium différent par de nombreux points : ils n'ont pas la même masse, la même charge électrique, etc. On peut distinguer différents noyaux, qui se distinguent par leur masse, leur charge électrique, et quelques autres différences mineures. Mais ces différences proviennent toutes du nombre de nucléons, de protons et de neutrons. Selon le nombre de protons et de neutrons, la masse du noyau et sa charge varieront. Dans ce qui va suivre, nous allons étudier comment la masse et la charge électrique du noyau dépendent du nombre de nucléons. Nous verrons aussi que le nombre de nucléon influence la forme du noyau, que ce soit son volume ou son rayon, mais pas sa densité.
La durée de vie et demi-vie
[modifier | modifier le wikicode]Il existe des noyaux atomiques qui sont instables, c’est-à-dire qu'ils vont spontanément se transformer en un autre nucléide moins énergétique. Pour cela, ils peuvent soit perdre de l'énergie, soit perdre/gagner des nucléons. Par exemple, un noyau instable peut se briser en deux noyaux plus petits. Il peut aussi émettre un nucléon pour se transformer en un autre noyau. Dans la plupart des cas, le noyau perd des nucléons, ce qui le transforme en un autre. Il peut aussi émettre de la lumière pour revenir à un état de moindre énergie, se transformant en un même nucléide, mais sans perdre de nucléons. Toutes ces transformations d'un noyau en un autre sont ce qu'on appelle des désintégrations radioactives. Nous verrons les différents types de désintégrations dans quelques chapitres, un futur chapitre leur étant dédié.
Les noyaux instables ont une certaine durée de vie moyenne, qui traduit le temps moyen entre leur création (le moment où le noyau se forme) et leur désintégration. Il faut noter que les désintégrations sont des évènements aléatoires, ce qui fait que la durée de vie est une durée de vie moyenne. Pour la quantifier, on utilise la demi-vie, à savoir la durée pour laquelle le noyau a une probabilité d' 1/2 de s'être désintégré. La durée de vie varie grandement selon les noyaux, allant de durée de vie infinitésimalement petites, tandis que d'autres mettent plusieurs millénaires avant de se désintégrer. Certains noyaux ont une durée de vie tellement faible qu'ils n'ont même pas le temps de capter des électrons. Ils ne peuvent donc pas former d'atomes, ce qui fait qu'ils n'ont pas d’éléments chimiques associés. Ces noyaux ont une durée de vie inférieure à secondes. Les autres noyaux peuvent capter des électrons et former des atomes chimiquement réactifs.
- Dans le prochain chapitre, nous verrons ce qui détermine la stabilité (la durée de vie) des noyaux atomiques. Nous verrons que la stabilité des noyaux dépend de leur nombre de protons et de neutrons. Les noyaux avec un excès de protons ou un excès de neutrons se désintègrent rapidement, alors que les noyaux avec approximativement autant de neutrons que de protons sont plus stables que les autres. De même, nous verrons que les noyaux avec un nombre de protons ou un nombre de neutrons pair sont plus stables. Enfin, nous verrons que les noyaux qui ont des nombres de protons précis (2, 8, 20, 28, 50, 82 ou 126 protons) sont plus stables que les autres, de même que ceux avec un nombre de neutrons égal à 2, 8, 20, 28, 50, 82 ou 126. Mais laissons cela au chapitre suivant. Nous verrons l'origine de ces comportements dans les chapitres de fin du cours, quand nous parlerons des modèles de la goutte liquide et des modèles en couche du noyau.
Le nombre de nucléons (numéro atomique et nombre de masse)
[modifier | modifier le wikicode]Le nombre de nucléons d'un noyau est appelé son nombre de masse et est noté A. Son nom vient du fait qu'il servait autrefois à mesurer la masse des atomes, comme nous l'avons dit dans le premier chapitre. Auparavant, les scientifiques mesuraient la masse des atomes par rapport à celle de l’hydrogène. Quand ils disaient que l'atome de Lithium-6 a un A égal à 6, cela voulait dire qu'il pèse aussi lourd que 6 atomes d'hydrogène. Le terme "nombre de masse " est resté, mais il désigne aujourd'hui le nombre de nucléons. Il faut dire que la masse de l'atome dépend principalement de celle du noyau, d'où cet abus de langage.
Le nombre atomique est égal au nombre de protons de l'atome. Pour les atomes non-ionisés, il est aussi égal au nombre d'électrons de l'atome (il y a autant d'électrons que de protons dans ces atomes). À l'origine, le nombre atomique identifiait la place dans le tableau périodique de Mendeleïev, qui correspond en réalité au nombre d'électrons (celui-ci dicte la chimie de l'atome en question). Le lien entre nombre d'électrons et de protons fait que le sens a depuis dérivé pour désigner le nombre de protons. En clair, le nombre atomique identifie l’élément chimique auquel il appartient, par son nombre de protons.
Le nombre de masse est la somme du nombre de protons Z et du nombre de neutrons N.
Il existe une notation spécialisée pour désigner tel ou tel atome. Avec celle-ci, on note le symbole de l'espèce chimique à laquelle appartient l'atome, puis on place le nombre de masse à haut à gauche et le nombre de protons en bas à gauche. Ainsi, un atome de l'espèce chimique N, contenant A nucléons dont Z protons sera noté comme suit : .
- Par exemple, l'atome de est composé de 12 nucléons dont 6 protons.
- Comme autre exemple, l'atome de est composé de 16 nucléons dont 8 protons.
- Comme autre exemple, l'atome de est composé de 18 nucléons dont 8 protons.

Le nombre de nucléons, de protons et de neutrons permettent d'identifier différents nucléides. Deux atomes appartiennent au même nucléide s'ils ont le nombre de protons et de neutrons (donc le même nombre de masse), ainsi que la même énergie. Certains noyaux ont le même nombre de neutrons ou de protons, ce qui permet de distinguer :
- les isobares, qui ont le même nombre de masse (le nombre de nucléons) ;
- les isotopes, qui ont le même nombre de protons, mais des nombres de neutrons différents ;
- les isotones, qui ont le même nombre de neutrons, mais des nombres de protons différents ;
- les noyaux miroirs, dont les nombres de protons et de neutrons sont échangés ;
- les isomères nucléaires ont le même nombre de neutrons et de protons, mais pas la même énergie.
Les isomères nucléaires
[modifier | modifier le wikicode]
Les isomères nucléaires sont deux atomes avec le même nombre de protons et de neutrons, mais pas la même énergie. L'énergie d'un noyau ne varie pas continûment, comme l'énergie d'un objet classique, mais est quantifiée, à savoir qu'elle évolue par paliers successifs. Cette particularité ne s'explique convenablement qu'avec la physique quantique et il n'y a pas d'explication classique. Parmi tous les paliers possibles, il y en a un qui correspond à l'état d'énergie minimal, celui où le noyau ne peut pas descendre plus bas. Ce palier est appelé l'état fondamental. Les nucléides qui ne sont pas à l'état fondamental sont plus énergétiques que les autres et sont dits en état excité.
Certains nucléides naissent directement en état excité, à la suite d'une réaction nucléaire ou lors d'une désintégration radioactive. D'autres noyaux sont initialement à l'état fondamental mais montent d'un ou plusieurs paliers en absorbant de l'énergie (en absorbant un photon ou sous l'effet de l'absorption thermique, par exemple). Les noyaux excités peuvent aussi redescendre d'un ou plusieurs paliers en perdant de l'énergie. Quand cela arrive, l'énergie perdue est émise du noyau sous la forme d'un photon, de lumière. Nous en reparlerons dans le chapitre sur la radioactivité, quand nous parlerons de la radioactivité gamma.
Les isobares
[modifier | modifier le wikicode]Des noyaux/atomes avec le même nombre de masse sont appelés des isobares. Des isobares ont généralement des nombres de protons et de neutrons différents, mais dont le nombre de masse est égal. Par exemple, un noyau avec un nombre de masse égal à 13 peut contenir soit 13 protons, soit 12 protons et 1 neutron, soit 11 protons et 2 neutrons, etc. Des isobares ont des masses identiques, en première approximation, du fait de la ressemblance de masse entre protons et neutrons. À contrario, des noyaux non-isobares ont des masses sensiblement différentes.
- Ouvrons une parenthèse, qui anticipe le chapitre sur les désintégrations radioactives. Il arrive que certains noyaux se transmutent, quand un proton se transforme en neutron (ou inversement) : une telle désintégration est appelée une désintégration Bêta. Cette désintégration conserve le nombre total de nucléon, mais pas le nombre de protons ou de neutrons. Vu que A est conservé, le noyau se transmute en un de ses isobares.
Les isotopes
[modifier | modifier le wikicode]Si deux noyaux ont le même nombre de protons, il se peut qu'ils aient des nombres de neutrons (et donc des nombres de masse) différents : ce sont des isotopes d'un même élément chimique. Voici quelques exemples :
- L'Hydrogène, avec son unique proton, a 3 isotopes : le Protium n'a pas de neutrons, le Deutérium a 1 neutron, le Tritium a 2 neutrons, etc.
- L'Hélium, avec deux protons : l’Hélium 3 possède 3 nucléons (2 protons et un neutron) et l'Hélium 4 en a 4 (2 protons et 2 neutrons).
- L'Uranium, avec ses 92 protons : l'Uranium 238 contient 238 nucléons, l'Uranium 235 en a 235, tandis que l'Uranium 234 en a 234.
- Le Carbone, avec 6 protons : le Carbone 12, le Carbone 13 et le Carbone 14 ont respectivement 12, 13 et 14 nucléons.

Les isotopes se comportent presque de la même manière du point de vue chimique, vu qu'ils ont le même nombre de protons (et donc d'électrons). Les isotopes occupent la même place dans le tableau périodique, ils appartiennent au même élément chimique, ce qui fait qu'on parle d'isotopes d'un élément chimique. Par exemple, tous les noyaux d'oxygène ont 8 protons, tous ceux d'uranium en ont 92, ceux de Thorium en ont 90, etc. Cependant, les isotopes d'un même élément chimique n'ont pas la même masse : les isotopes avec beaucoup de neutrons seront plus lourds que ceux avec moins de neutrons. La conséquence est que certaines réactions chimiques ou physiques ne seront pas identiques entre isotopes, du fait de cette faible différence de masse. Cela a de nombreuses applications en géologie, l'ensemble de la géologie isotopique est d'ailleurs basée sur ce genre de phénomènes !

Historiquement, l'existence des isotopes a rapidement été suggérée, avant même qu'on connaisse l'existence du noyau atomique ! Dès 1886, William Crookes a supposé que les atomes d'un même élément n'ont pas tous la même masse. Cette hypothèse visait à expliquer les résultats des mesures des masses atomiques, qui variaient selon les auteurs et les conditions expérimentales. Mais cette piste a été accueillie assez fraîchement, par manque de preuves expérimentales. Mais les preuves ont commencé par s'accumuler et l'existence des isotopes s'est imposée progressivement.
En 1914, Boltwood remarqua que du Plomb est presque toujours associée à la Pechblende (un minerai d'Uranium). Frederic Soddy suppose, à juste titre, que le Plomb provient de la désintégration de l'Uranium et prédit (sur la base de sa loi de déplacement radioactif) que sa masse atomique doit être de 206. Il prédit, sur la base d'arguments similaires, que le Plomb tiré de la Thorite uranifère doit être de 208. Les deux formes de Plomb, provenant de désintégrations différentes, doivent avoir des poids atomiques différents. Vu que le poids atomique moyen du Plomb est de 207,2, il suppose que le Plomb est composé de deux isotopes : un avec A = 206 et un autre avec A = 208, les proportions donnant une moyenne de 207,2. La pesée expérimentale, réalisée par Theodore Richards et Max Lembert, confirme ces prédictions.
Par la suite, Aston découvrit que des atomes non-radioactifs ont aussi des isotopes. Pour cela, il ionise du Néon et accélère les ions ainsi créés via un champ électromagnétique. Ceux-ci sont ensuite envoyés sur une plaque photographique, le point d'impact sur la plaque dépendant du rapport énergie/masse. Si le Néon n'a qu'un seul isotope, on ne devrait observer qu'un seul point d'impact. Mais si le Néon n'a que deux isotopes, on doit observer deux point d'impact. L'expérience montre deux points d'impact, prouvant que le Néon possède majoritairement deux isotopes : un d'une masse atomique de 20 et un autre d'une masse atomique de 22. De plus, l'analyse de résultats montre que 90% du Néon a un A = 20 et 10% de A = 22. Cela permet de retrouver la masse atomique obtenue par les mesures précédentes, qui donnaient une masse atomique de 20,2 pour le Néon.
La forme et la taille du noyau
[modifier | modifier le wikicode]
Les nucléons et noyaux n'ont pas de limites précises, pas de frontière qui sépare leur intérieur de leur extérieur, pas de forme stable. Étant composés de particules plus élémentaires, les assimiler à une sphère exacte est une approximation certes convenable, mais reste quand même faux. En réalité, les nucléons et les noyaux sont composés de particules qui bougent sans cesse autour de leur centre de masse. Après, on peut certes calculer un rayon et un volume moyen pour cet ensemble de particules, mais difficile de faire passer ces moyennes pour une quantité physique réelle du noyau. Autant dire que les notions de forme, de rayon ou de volume du noyau sont vraiment floues.
Dans beaucoup d'illustrations, on représente le noyau sous la forme d'une framboise où les protons sont roses et les neutrons sont bleus. Et cette illustration n'est pas le fruit du hasard : il semble logique que les nucléons s'assemblent de manière compacte, donnant un noyau approximativement sphérique. Expérimentalement, les noyaux stables (qui ne se désintègrent pas en noyaux plus petits) sont dans ce cas et ont une belle forme ronde. Mais certains noyaux beaucoup plus instables (c’est-à-dire qui se brisent rapidement en noyaux plus petits) ne sont pas dans ce cas et ont une forme bizarroïde. Ils peuvent avoir des formes de double poires, de triple ou quadruples poires, etc. Pour les connaisseurs, ils ressemblent beaucoup aux orbitales atomiques.
Dans ce qui va suivre, nous allons prendre le cas d'un noyau sphérique, pour simplifier les calculs. Cela signifie que nous nous limitons aux noyaux assez gros, avec un nombre de masse élevé. En effet, un noyau trop petit n'a pas assez de nucléons pour ressembler à une sphère. Prenez par exemple l'atome d'Hélium-4, avec ses quatre nucléons : sa forme n'est pas vraiment sphérique. On estime que les noyaux ont une forme sphérique digne de ce nom quand leur nombre de nucléons dépasse la quarantaine (en clair : A > 40).
Le volume des noyaux sphériques
[modifier | modifier le wikicode]
Pour un noyau sphérique, les nucléons sont empilés de manière assez compacte, de qui fait qu'il y a peu d'espace vide entre les nucléons. En négligeant cet espace vide, on trouve que le volume du noyau est la somme du volume des nucléons. Et vu que tous les nucléons ont le même volume et le même rayon . Pour un noyau de nombre de masse A, on a :
Le résultat est donc que le volume d'un noyau sphérique est proportionnel à son nombre de masse.
- Nous réutiliserons ce résultat dans le chapitre sur le modèle nucléaire "de la goutte liquide".
Le rayon des noyaux sphériques
[modifier | modifier le wikicode]La formule qui donne le volume du noyau nous permet de calculer son rayon en fonction du nombre de masse.
On remplace V par la valeur précédente :
Simplifions par
Prenons la racine cubique :
On a donc le résultat suivant :
Pour sonder les noyaux, les physiciens les font entrer en collision avec des particules plus légères : des électrons, des neutrons, des particules alpha, ou autres. En observant les trajectoires après collision des particules, on peut en déduire le rayon du noyau, sa masse, et bien d'autres propriétés. C'est d'ailleurs ce qu'a fait Rutherford dans ses expériences avec des particules alpha et/ou des neutrons ! Et selon la particule utilisée, le rayon du noyau n'est pas le même.
- Si on sonde le noyau avec des électrons (ou avec n'importe quelle particule chargée), le rayon du noyau mesuré a une valeur particulière, appelée le rayon de charge du noyau. Avec elle, le rayon d'un nucléon est approximativement égal à 1,4 femtomètres, ce qui est extrêmement petit.
- Si on sonde le noyau avec des particules neutres électriquement, le résultat est différent et porte le nom de rayon de masse. De ce rayon de masse, on peut montrer que les nucléons ont un rayon de 1,07 femtomètres. On a donc :
Les deux valeurs sont différentes pour une bonne raison : elles ne mesurent pas la même chose. Sonder le noyau avec des particules chargées renseigne sur la localisation des protons, alors qu'utiliser des particules neutres renseigne sur la localisation de tous les nucléons. Si on sonde le noyau avec des particules chargées, celles-ci vont surtout réagir avec les protons via l'interaction électrique, mais réagiront moins avec les neutrons non-chargés. Le rayon de charge renseigne donc sur la distribution de la charge électrique du noyau. À l'inverse, sonder le noyau avec les particules neutres n'a pas ce "défaut". Les particules incidentes réagiront de la même manière avec les protons et neutrons, via des collisions tout ce qu'il y a de plus banales. Le rayon de masse renseigne donc sur la distribution des particules, et donc de la masse, dans le noyau.
Le fait que le rayon de charge et le rayon de masse soient différents nous dit que les protons et neutrons ne sont pas répartis de manière homogène dans le noyau. Dans les faits, le rayon de charge est plus grand que le rayon de masse, ce qui signifie que les charges ont tendance à se regrouper vers l'extérieur, vers la surface du noyau. Rien d'étonnant à cela : les protons se repoussent du fait de leur charge positive. Ils vont donc s'éloigner du centre du noyau et ont tendance à se placer sur la périphérie du noyau, à sa surface, de telle manière qu'ils soient éloignés le plus possible entre eux sur la sphère nucléaire. Évidemment, les protons ne sont pas statiques et bougent, et ont tendance à faire pas mal d'incursions vers le centre du noyau, ce qui fait que leur localisation en périphérique est purement statistique. Mais elle est suffisante pour que rayon de charge et rayon de masse soient assez différentes.
Quoi qu’il en soit, rayon de masse et de charge sont assez similaires. Le rayon d'un noyau est approximativement 10 000 fois plus petit que l'atome : le rayon du noyau ne vaut que 0,01 % du rayon total de l'atome. Au passage, vous remarquerez que cela explique les résultats de l’expérience de Rutherford : seul 0,01 % des particules alpha étaient déviées.
La surface des noyaux sphériques
[modifier | modifier le wikicode]À partir du rayon, on peut trouver la surface du noyau. En effet, l'aire de la sphère nucléaire vaut exactement : , avec . On a donc :
En omettant les constantes et le rayon des nucléons, on trouve alors :
Cette formule nous dit que la surface du noyau est une puissance du nombre de masse (la puissance 2/3, pour être précis).
- Nous réutiliserons ce résultat dans le chapitre sur le modèle nucléaire "de la goutte liquide".
La densité du noyau
[modifier | modifier le wikicode]Intéressons-nous maintenant à la densité du noyau atomique. Les physiciens ont depuis longtemps étudié la répartition de la masse dans le noyau, pour voir si certaines portions sont plus denses que d'autres. Après tout, les nucléons s'attirent entre eux, sans quoi les noyaux ne se formeraient pas. Cette attraction devrait compacter les nucléons vers le centre du noyau, ce qui fait que la densité évolue avec la distance au centre du noyau : les nucléons sont fortement liés au centre, un peu moins à la surface du noyau. Dans ce qui va suivre, nous allons voir comment la densité est répartie dans le noyau. On va supposer que la masse du noyau est la somme de la masse de ses nucléons, ce qui est une approximation de la réalité (on verra dans la section suivante que c'est plus compliqué). On va aussi supposer que protons et neutrons ont grosso-modo la même masse (on sait que ce n'est pas exact, mais que la différence entre les deux masses est négligeable).
Le cœur du noyau
[modifier | modifier le wikicode]Dans les noyaux sphériques, les nucléons sont empilés de manière compacte, ce qui fait que la densité du noyau est relativement constante dans le noyau (ici, je confonds volontairement densité et masse volumique, pour simplifier). Si c'est le cas, on peut calculer la densité du noyau à partir de la densité des nucléons, en posant la densité du noyau et celle d'un nucléon. On a alors :
On peut calculer la densité en fonction du rayon d'un nucléon. Il suffit d'injecter dans la formule précédente, ce qui donne :
On voit que densité du noyau et d'un nucléon sont égales et doivent être approximativement les mêmes pour tous les noyaux. Les seules variations de densité entre noyaux doivent provenir des différences de densité entre protons et neutrons, mais elles devraient être négligeables pour la plupart des atomes courants.
- Pour ceux qui ont déjà lu le cours, ou qui savent déjà ce qu'est l'interaction forte, on peut expliquer la relative constance de la densité dans le noyau d'une autre manière. C'est dû au fait que la force forte est une force à courte distance. Au-delà d'une certaine distance, elle sature, dans le sens où elle est trop faible pour avoir le moindre impact. Chaque nucléon réagit donc seulement avec ses voisins proches et pas ceux plus éloignés. Si ce n'était pas le cas, on devrait observer une densité qui augmente progressivement en progressant vers le centre, comme on peut l'observer avec un fluide soumis à la gravité, par exemple.
La pellicule de surface
[modifier | modifier le wikicode]
Mais ce résultat a cependant quelques faiblesses et ne rend pas fidèlement compte de la réalité expérimentale. Si tous les noyaux ont grosso-modo la même densité, celle-ci n'est pas tout à fait constante dans le noyau. Si la densité est bien constante au centre, elle diminue à proximité de la surface du noyau. Tout se passe comme si une pellicule de faible densité entourait un cœur de densité constante. La densité diminue très rapidement dans la pellicule de surface. Les physiciens modélisent cela avec la formule de Saxon-Woods, qui donne la densité selon la distance au centre du noyau. Si on pose :
- la densité à une distance r du centre du noyau
- la densité au centre du noyau ;
- r la distance par rapport au centre du noyau ;
- R le rayon du noyau, dans la partie où la densité est constante ;
- a un paramètre proche de la longueur sur laquelle la densité chute rapidement en périphérie.
Le paramètre est approximativement de 0.54 femtomètres, et est le même pour tous les noyaux.
L'équation précédente permet de déterminer l'épaisseur de la peau, notée e, à savoir l'épaisseur de la couche où la densité nucléaire passe de 90% de sa valeur maximale à seulement 10%. Pour cela, on peut reformuler la formule de Saxon-Woods comme suit.
Tout d'abord, on divise par :
On inverse :
On réorganise les termes :
On prend le logarithme :
On multiplie par a :
On isole r :
On peut ensuite calculer le rayon pour lequel et le rayon pour lequel .
La différence entre ces deux rayons n'est autre que l'épaisseur de la peau e.
Si on fait le calcul avec a = 0.54 femtomètres, on trouve e = 2,4 femtomètres.
La masse du noyau
[modifier | modifier le wikicode]Pour ce qui est de la masse, il est raisonnable de dire que la masse d'un noyau est la somme de la masse de ses nucléons. Si on suppose que chaque nucléon a une masse , la masse d'un noyau de nombre de masse vaut alors :
Si on veut être plus précis, on doit distinguer la masse du proton de celle du neutron . La masse dépend alors du nombre de protons et du nombre de neutrons :
Mais en réalité, il existe une différence entre la masse mesurée et celle calculée par la formule ci-dessus. Elle est appelée le déficit de masse et est notée : Elle peut aller jusqu’à 10 à 15 % de la masse calculée.
Le spin et le moment magnétique du noyau
[modifier | modifier le wikicode]Comme toutes les particules, le noyau tourne sur lui-même, ce qui lui donne un moment cinétique intrinsèque appelé le spin (pour rappel, le moment cinétique est une quantité conservée qui est aux rotations ce que l'impulsion mv est aux translations). Le spin du noyau est un vecteur dont la direction est l'axe de rotation du noyau et dont la norme est la vitesse de rotation. Le spin du noyau est la somme des moments cinétiques des protons et neutrons, de la même manière que le spin d'un nucléon est la somme des moments cinétiques des quarks qui le composent.
Le moment cinétique du noyau
[modifier | modifier le wikicode]Un nucléon a deux moments cinétiques : un spin lié au fait qu'il tourne sur lui-même, et un moment cinétique angulaire lié au fait qu'il tourne autour du centre du noyau. Pur faire une comparaison, prenons le moment angulaire de la planète Terre : d'un côté elle tourne autour du Soleil, de l'autre elle tourne sur elle-même. On peut donc lui attribuer deux moments cinétiques : un moment cinétique intrinsèque lié à la rotation, et un moment cinétique angulaire lié à sa révolution autour du Soleil. Pour un nucléon dans le noyau, c'est pareil, sauf que le nucléon tourne sur lui-même et autour du centre du noyau. Ces deux moments cinétiques sont des vecteurs, dont la direction est l'axe de rotation/révolution, et la norme la vitesse de rotation/révolution. Le moment cinétique total d'un nucléon est la somme vectorielle de ces deux moments angulaires. En notant le spin d'un nucléon , son moment angulaire orbital et son moment angulaire total, on a :
Le moment angulaire du noyau, noté I, est la somme vectorielle des moments angulaires de tous les nucléons, ce qui donne :
Le spin des nucléons a une grande importance dans la structure de l'intérieur du noyau. Pour comprendre pourquoi, faisons quelques rappels sur les bosons et fermions. Les bosons sont des particules dont le spin ne peut prendre qu'une valeur entière, comme 0, 1, 2, 3, 4, etc. À l'inverse, les fermions ont des spins fractionnaires, et plus précisément des spins qui sont de la forme . Cette distinction entre bosons et fermions est de première importance. Divers résultats en physique quantique et en physique statistique montrent que les deux types de particules se comportent très différemment dans de nombreuses situations. Les protons et neutrons sont tous des fermions, dont le spin ne peut valoir que deux valeurs : et . Diverses théories disent que les nucléons s'assemblent en couples dans le noyau, qui se comportent comme des bosons. Et cela a un grand impact dans les théories de la structure nucléaire.
On vient de voir que le spin est quantifié, à savoir qu'il ne peut prendre que des valeurs bien précises, ici entières ou demi-entières. Mais on peut aller plus loin : le moment orbital est lui aussi quantifié. Et par corollaire, le moment cinétique total aussi. Dans le détail, une formule de la mécanique quantique nous dit que le moment cinétique J, S ou L mesuré sur un axe, pour un objet, vaut :
- , avec j un entier quelconque.
Si on fait le calcul du carré de la norme du vecteur J, on a :
Les deux équations précédentes sont tout aussi valables si on remplace J par S ou par L.
Le moment magnétique du noyau
[modifier | modifier le wikicode]Du fait de sa rotation et de sa charge, le noyau se comporte comme un aimant. En effet, une particule chargée qui tourne sur elle-même génère un champ magnétique. On s'attend donc à ce que le noyau ait un champ magnétique crée par la conjonction de sa charge et de son spin. Pour décrire l'aimantation du noyau, on lui donne un moment magnétique, un vecteur dont la direction est celle de l'axe nord-sud de l'aimant, et la norme est l'intensité du champ magnétique. Moment magnétique , charge et moment cinétique sont reliés par l'équation suivante :
On peut récrire cette équation comme suit :
- , avec le magnéton nucléaire.
Précisons que le moment cinétique est la somme des spins et des moments angulaires des nucléons. On a alors :
Dans le noyau, la force nucléaire fait que les spins des nucléons ne se dirigent pas n'importe comment. La configuration la plus énergétiquement favorable est celle où les nucléons se groupent par deux, de telle manière que leurs spins soient opposés. Par exemple, un proton va s'associer avec un neutron de telle manière que l'un ait un spin égal à et l'autre un spin de . En clair, les spins s'annulent deux à deux. Précisons que la même chose survient pour les moments angulaires.
Le spin total du noyau, qui est la somme des spins des nucléons, dépend donc de la parité du nombre de masse. Si le noyau a un nombre pair de nucléons, alors son spin est nul. Mais si le nombre de masse est impair, alors son spin sera demi-entier. En théorie, le moment magnétique du noyau est donc soit nul, soit égal à la moitié du magnéton nucléaire. Mais cette tendance n'est pas parfaite, surtout quand le noyau a beaucoup de nucléons. Dans les faits, certains gros noyaux ont un moment magnétique plus important que le magnéton nucléaire. Mais aucun n'a été observé avec un moment magnétique supérieur à .
Les moments électriques du noyau
[modifier | modifier le wikicode]La répartition des charges électriques dans le noyau est rarement homogène, ce qui fait que l'on peut observer des déviations par rapport à la loi de Coulomb. Si on est éloigné du noyau, on peut considérer que sa charge est ponctuelle et a loi de Coulomb s'applique à la perfection. Mais si on s'approche, la répartition inhomogène des charges change la donne et on observe de petites déviations. Ces déviations sont la somme de ce qu'on appelle des moments électriques. Le plus connu est le dipôle électrique, qui est composé d'une charge positive et d'une charge négative espacés d'une distance non-nulle. Mais il existe aussi des tri-pôles (trois charges séparées), des quadrupôles (champ crée par quatre charges séparées), etc. Si on prend le champ électrique d'un noyau, on peut le voir comme la somme d'un champ qui suit la loi de Coulomb, du champ en crée par un dipôle électrique, d'un champ en d'un tri-pôle, d'un champ en d'un quadrupôle, etc. Les moments électriques dépendent fortement de la forme du noyau. Si celui-ci est sphérique, on n'observe que le champ de la loi de Coulomb, sauf quand on est très près du noyau. Mais si le noyau est déformé, on observe une contribution quadripolaire, éventuellement d'autres moments électriques. Par exemple, un noyau de forme ovale a de bonnes chances d'avoir un moment quadripolaire, sauf si les charges sont exceptionnellement bien réparties.
La cohésion du noyau
Dans le chapitre précédent, nous avons vu que la masse d'un noyau n'est pas la somme des masses de ses nucléons. Il existe une différence entre la masse calculée ainsi et la masse mesurée. La différence en question est souvent assez importante, pouvant aller jusqu’à 10 à 15 % de la masse calculée. La différence entre masse calculée et mesurée est appelée le déficit de masse et est notée :
La différence de masse provient bien de quelque part et il est possible d'en expliquer la provenance. Vu que c'est la différence entre la masse des nucléons individuels et celle de ces mêmes nucléons agencés en noyau, on devine qu'il s'agit d'une masse qui se perd lors de la formation du noyau. En utilisant la formule d'équivalence masse-énergie d'Einstein , on déduit que cette différence de masse correspond à une énergie , appelée énergie de liaison. La masse du noyau est donc :
- , avec l'énergie de liaison.
L'énergie de liaison n'est autre que l'énergie qui se dégage lors de la formation du noyau. La masse manquante s'est donc convertie en énergie de liaison lors de la formation du noyau. On peut aussi voir l'énergie de liaison comme l'énergie qu'il faut fournir pour séparer le noyau en nucléons individuels. On devine donc que cette énergie est ce qui tient les nucléons ensemble, dans le noyau, et les empêche de quitter le noyau. Ce qui nous amène au sujet de ce chapitre : pourquoi certains noyaux sont stables, alors que d'autres se désintègrent en noyaux plus petits par radioactivité ? On sait que la raison est liée à l'énergie de liaison : plus elle est forte, plus le noyau est censé être stable.
On pourrait croire que plus l’énergie de liaison est élevée, plus le noyau est stable. Mais il faut aussi prendre en compte le nombre de nucléons du noyau, car l'énergie de liaison est répartie sur tous les nucléons du noyau. Selon que l'énergie de liaison est répartie sur beaucoup ou peu de nucléons, la stabilité du noyau ne sera pas la même. C'est donc l'énergie de liaison par nucléon qui est importante pour la stabilité du noyau : plus elle est grande, plus chaque nucléon est lié aux autres. Le graphique ci-dessous donne l'énergie de liaison par nucléon pour la majorité des noyaux connus. On voit qu'elle dépend du nombre de nucléons, avec un maximum localisé au niveau du Fer 56. Cet isotope du Fer est donc le noyau e plus stable qui existe, les autres l'étant un peu moins. Tout noyau qui n'est pas du Fer tend donc à fusionner avec d'autres noyaux ou à se désintégrer jusqu'à se transmuter en Fer 56.

La vallée de stabilité
[modifier | modifier le wikicode]Le graphique précédent illustre l'énergie de liaison en fonction du nombre de masse. Mais on peut aussi regarder ce qui se passe en fonction du nombre de protons et de neutrons. Le graphique ci-dessous représente l'énergie de liaison (représentée par des couleurs), en fonction du nombre de neutrons (abscisse) et de protons (ordonnée). On voit que les noyaux stables sont rassemblés sur une zone assez petite, appelée : vallée de stabilité. Les noyaux stables sont localisés sur une courbe continue proche de la droite où , avec cependant une petite inflexion vers le haut de la courbe. Cette courbe de noyaux stables est appelée la limite de stabilité. En clair, les noyaux stables ont un nombre de protons et de neutrons assez équilibré, presque égal. Les noyaux avec un excès de protons par rapport aux neutrons sont instables, de même que les noyaux avec un déficit majeur en protons. Cependant, pour les noyaux avec beaucoup de nucléons, on observe un léger excès de neutrons par rapport aux protons, qui est suffisant pour infléchir légèrement la zone de stabilité.

La seule déduction possible est que l'énergie de liaison dépend du rapport entre nombre de protons et de neutrons. Cette dépendance reflète l'implication de deux processus distincts : l'interaction électrostatique entre protons, qui se repoussent, et un processus quantique assez compliqué à décrire.
Si on pouvait supprimer l’influence de l'interaction électrostatique, les noyaux les plus stables seraient ceux avec un nombre de protons identique au nombre de neutrons. La raison est que neutron et proton sont presque identiques, les seules différences étant leur charge électrique et une faible différence de masse qu'on peut négliger. Au niveau du formalisme de mécanique quantique, on peut les voir comme deux versions d'une même particule appelé le nucléon quantique. Celui-ci peut prendre deux états différents : un chargé qui correspond au proton et un autre qui est le neutron. Ces deux états se distinguent par un nombre quantique, appelé l'isospin, qui est de pour le neutron et de pour le proton. Si on assemble plusieurs nucléons ensemble, l'isospin est la somme des isospins de chaque nucléon. Or, une énergie est associée à l'isospin et les calculs nous disent que celle-ci est minimale si l'isospin du noyau est nulle, ou du moins la plus faible possible. Ce qui n'est possible que pour un nombre égal de protons et de neutrons. On en déduit que les noyaux les plus stables sont ceux avec autant de protons que de neutrons.
Mais l'équilibre d'isospin est contrarié par la charge électrique des protons : ceux-ci possèdent la même charge positive, ce qui fait qu'ils se repoussent. Cela ajoute de l'énergie au noyau, réduisant sa stabilité. Un noyau avec trop de protons va exploser de l'intérieur sous l'effet de la répulsion proton-proton. La stabilité maximale est obtenue via un compromis entre la répulsion électrostatique et l'équilibre d'isospin.
L'influence de valeurs de Z et N particulières
[modifier | modifier le wikicode]À l'intérieur de la vallée de stabilité, les physiciens ont remarqué que l'énergie de liaison ne varie pas continûment et que certains noyaux sont beaucoup plus stables que les autres. Pour en donner un exemple, regardons l'énergie de liaison pour tous les atomes de 125 nucléons, illustrée dans le graphique ci-dessous. On voit qu'elle atteint un maximum aux alentours de 50 protons. Si on réitère l'analyse pour un nombre de masse autre que 125, on observe un résultat identique : les noyaux avec 50 protons semblent plus stables que les autres.

Les nombres magiques
[modifier | modifier le wikicode]Les expériences ont montré que les noyaux les plus stables sont ceux avec un nombre de protons ou de neutrons égal à 2, 8, 20, 28, 50, 82 ou 126. Ces valeurs sont appelées des nombres magiques. On peut citer, par exemple :
- l'oxygène (8 protons) ;
- l'hélium (2 protons) ;
- le calcium (20 protons) ;
- le nickel (28 protons) ;
- le deutérium (2 neutrons).
Et les noyaux pour lesquels le nombre de protons et le nombre de neutrons sont des nombres magiques sont encore plus stables que les autres : ils sont dits doublement magiques. On pourrait par exemple citer
- l'hélium 4 (2 protons et 2 neutrons) ;
- l'oxygène 16 (8 protons et 8 neutrons) ;
- le silicium 42 (14 protons et 28 neutrons) ;
- le calcium 40 (20 protons et 20 neutrons) ;
- le calcium 48 (20 protons et 28 neutrons) ;
- le nickel 48 (28 protons et 20 neutrons) ;
- le rhodium 103 (45 protons et 58 neutrons) ;
- le plomb 208 (82 protons et 126 neutrons).
Une explication de ce phénomène sera donnée dans quelques chapitres, quand nous parlerons du modèle en couche du noyau atomique.
Les noyaux à Z ou N pairs/impairs
[modifier | modifier le wikicode]Une autre observation est que les noyaux avec un nombre pair de protons ou de neutrons sont plus stables que les autres, même si le nombre en question n'est pas un nombre magique. Les noyaux avec Z et N pairs sont plus stables que ceux qui ont uniquement un Z pair ou un N pair. Ils sont dits doublement pairs. La grande majorité des nucléides connus ont un Z ou un N pair : sur 253 nucléides stables, 153 ont un Z et un N pair. Par contre, seulement 5 ont à la fois un Z et un N impairs. Il s'agit du Deutérium, du Lithium-6, du Bore-10, de l'Azote-14, et du Tantale-180.
Les rayonnements radioactifs
En 1896, le savant Becquerel remarqua que l'Uranium émet de la lumière fortement énergétique, y compris quand il est plongé dans le noir. La rumeur veut qu'il ait découvert cela par pure sérendipité, en laissant traîner un échantillon d'Uranium sur une plaque photographique emballée dans du papier. Il remarqua que l'Uranium avait impressionné la plaque alors que celle-ci n'avait pas été exposée à la lumière. Il en déduisit que l'Uranium avait impressionné la plaque avec un rayonnement électromagnétique invisible. Après avoir d'abord pensé à un phénomène dit de phosphorescence, il remarqua rapidement que l'Uranium émettait des rayonnements sans pour autant avoir absorbé de la lumière auparavant. Il ne fut cependant pas capable d'expliquer plus ce comportement et ne pût expliquer l'origine du rayonnement et sa nature. Il ne le savait pas encore, mais il avait été le premier à observer l'effet des rayonnements radioactifs dans son laboratoire...
Quelques années plus tard, les époux Pierre et Marie Curie étudièrent les rayonnements découverts par Becquerel. Ils utilisèrent des échantillons de Pechblende (un minerai d'Uranium), dont une analyse minutieuse permis d'en extraire deux composés radioactifs : un très actif qu'ils appelèrent Polonium (en référence à la Pologne, pays natal de Marie Curie) et un autre moins actifs connu aujourd'hui sous le nom de Radium. Ils remarquèrent que d'autres substances émettaient elles aussi des rayonnements : le thorium, l'actinium, etc. Vu que ces composés restaient radioactifs malgré les nombreux traitements chimiques subits, il leur était évident que la radioactivité est un phénomène non-influencé par les réactions chimiques.
Quelques années plus tard, Rutherford découvrit que tous les rayons émis par les substances radioactives ne sont pas uniques. Il en existe plusieurs types et il identifia les rayons alpha des rayons bêta. Des recherches ultérieures, menées avec le physicien Frederic Soddy, montrèrent de plus que ces rayons sont en réalité des particules. Il montra aussi que les particules alpha sont similaires aux atomes d'Hélium. Il montra que leur spectre est identique à celui des atomes d'Hélium et qu'elles ont la même masse que ce dernier. En 1900, le physicien Paul Villard découvrit les rayons dits gamma et montra qu'ils sont similaires aux rayons X, à l’exception de leur énergie, bien plus importante.
Rapidement, les physiciens supposèrent que les rayonnements radioactifs sont émis par le noyau et sont donc des phénomènes nucléaires. La radioactivité est tout simplement l'émission de rayonnement ou des particules. L'émission de ces rayonnements radioactifs a lieu après une désintégration radioactive, c'est à dire quand un noyau se transforme en un autre noyau, un autre nucléide. Tous les noyaux ne sont pas radioactifs : les désintégrations concernent seulement les noyaux atomiques dit instables, qui peuvent se désintégrer. Les noyaux stables ne se désintégrant pas (ou très in-fréquemment) et restent les mêmes.
Les types de rayonnements
[modifier | modifier le wikicode]Les scientifiques ont identifié plusieurs rayonnements radioactifs, qu'ils ont nommés avec l'alphabet grec : rayonnements alpha, bêta, gamma. Lors de l'étude des rayonnements radioactifs, les scientifiques ont cherché à savoir s'ils étaient chargés électriquement. Pour cela, ils les ont fait passer dans un champ magnétique, pour vérifier s'ils étaient déviés. Il se trouve que certains d'entre eux le sont, ce qui signifie qu'ils ont une charge électrique, alors que d'autres ne le sont pas. Pour ceux qui sont déviés, l'angle de déviation varie suivant ce qui est émis par l'atome, signe que les rayonnements n'ont pas tous la même masse. Les scientifiques ont alors identifié plusieurs rayonnements :
- le rayonnement alpha, chargé positivement, avec une masse importante ;
- le rayonnement bêta, chargé positivement ou négativement, avec une masse plus faible ;
- le rayonnement gamma, sans charge et sans masse, identique à de la lumière ;
- le rayonnement neutronique, non-chargé, avec la même masse que le neutron ;
- le rayonnement protonique, chargé positivement, avec la même masse que le proton.
Suite à d'autres observations, les scientifiques purent déterminer quelle était la nature de ces rayonnements. Pour résumer, le rayonnement alpha est un noyau d'hélium, que le rayonnement bêta est un électron (ou un anti-électron) et que les rayons gamma sont de la lumière fortement énergétique.
| Type de rayonnement | Charge électrique | Particule/nature |
|---|---|---|
| Alpha | Noyau d'Hélium-4 | |
| Bêta- | Électron | |
| Bêta+ | Positron (anti-électron) | |
| Neutronique | Neutron | |
| Protonique | Proton | |
| Gamma | Lumière/Photon |

Les rayons gamma : des photons très énergétiques
[modifier | modifier le wikicode]Les rayonnements gamma sont de la lumière très énergétique, de quelques keV à plusieurs centaines de GeV, bien plus énergétique que les rayons X. Leur longueur d'onde est inférieure à mètres (un picomètre), ce qui donne une fréquence supérieure à Hertz (des exahertz).

Chaque élément chimique/nucléide émet un rayonnement gamma assez particulier. Les rayons gamma émis ont une énergie qui est répartie sur un intervalle de fréquence assez large, appelé le spectre gamma. Mais cela ne signifie pas que toutes les valeurs dans cet intervalle sont équiprobables. On observe généralement un excès de photons émis, pour certaines valeurs de l'énergie et un déficit pour d'autres. Si on compte le nombre de rayons gamma émis par un nucléide et qu'on les classe selon leur énergie E, on obtient un graphique appelé le spectre d'émission gamma. Celui-ci varie pour chaque élément chimique/nucléide : deux nucléides différents ont des spectres gamma différents. Ci-dessous sont illustrés les spectres du Cobalt-60 et du Césium-137 : on voit qu'ils ne sont pas identiques.
 |
 |
Les rayons alpha : des noyaux d'Hélium-4
[modifier | modifier le wikicode]
Les expériences de déviation magnétique ont montré que les rayonnements alpha sont déviés dans le même sens qu'un courant qui irait dans le même sens. Cela prouve qu'ils sont chargés électriquement et que cette charge est positive, égale à (deux fois la charge du proton). Ils ont une masse assez élevée, égale à celle de quatre nucléons. En conséquence, on peut supposer qu'il s'agit d'un fragment de noyau qui a quitté son noyau d'origine, quelle qu’en soit la raison. Ce morceau doit contenir, d'après sa masse, quatre nucléons, dont seulement deux sont chargés. On en déduit qu'il s'agit de noyaux d'Hélium-4, composés de deux protons et de deux neutrons.

Comme pour les rayons gamma, on peut établir un spectre d'émission alpha, en comptant le nombre de particules alpha émises avec une énergie E. La différence avec le spectre gamma est qu'il est plus petit, compressé dans un intervalle bien plus restreint. Chaque nucléide émet des particules alpha dans un intervalle très précis, qui lui est propre. Sur le spectre alpha, chaque nucléide forme un pic assez abrupt, dont la position est spécifique au nucléide. Le pic est centré autour d'une valeur d'énergie E et est de plus symétrique (ce qui veut dire qu'il y a autant de particules alpha émises avec une énergie < à E que de particules émises avec une énergie supérieure)

Les rayons bêta : électrons et positrons
[modifier | modifier le wikicode]Les expériences de déviation ont prouvé que les rayons bêta sont des particules chargées, qui possèdent une masse. Les premières expériences semblaient montrer que les rayons bêta sont chargées négativement, avec une masse identique à celle de l’électron. Il était naturel de croire que toutes les particules bêta sont des électrons. Mais des expériences ultérieures ont montré que certaines désintégrations bêta produisaient des particules bêta toutes autres. Celles-ci ont la même masse que l’électron, mais sont chargées positivement. Il s'agit en fait d'anti-électrons (l’anti-particule de l’électron), auxquelles on a donné le nom de positrons. Pour résumer les particules bêta sont soit des électrons, soit des positrons. On leur donne parfois le nom de particules bêta+ (positron) et bêta- (électron), pour indiquer leur charge électrique.
Les particules bêta ont une énergie cinétique variable, comprise entre zéro et une valeur maximale. Par exemple, la désintégration bêta du Bismuth 210 crée des électrons dont l'énergie est comprise entre 0 et 1,15 électron-volts, avec une moyenne à 0,4 électron-volts. Encore une fois, on peut établir un spectre bêta en faisant le compte pour un grand nombre de désintégrations bêta.

Pénétration des rayonnements radioactifs dans la matière
Les rayonnements radioactifs peuvent pénétrer dans la matière sur quelques centimètres avant d'être stoppés. Mais tous n'ont pas la même facilité à pénétrer la matière : certains sont arrêtés par une simple feuille de papier, alors que d'autres traversent du métal, voire du béton. Le rayonnement alpha est notamment arrêté par une simple feuille de papier, signe que celui-ci est une particule massive qui interagit fortement avec la matière. Le rayonnement bêta est arrêté par une feuille d'aluminium. Quant au rayonnement gamma, il demande plusieurs centimètres de plomb pour être stoppé. Le rayonnement neutronique est arrêté par la matière assez difficilement : il faut le ralentir avec une grosse épaisseur de matière (plusieurs centimètres d'eau ou des murs de béton renforcés avec du bore).

L'interaction matière-rayons alpha/bêta/neutriniques
[modifier | modifier le wikicode]
Ces différences proviennent des charges et de la masse des rayonnements : les rayonnements lourds sont arrêtés plus rapidement que les légers, de même que les rayonnements chargés. La raison à cela est que les rayons qui traversent la matière sont soumis à des interactions électromagnétiques entre matière et atomes. Elles sont de plusieurs types, mais on peut les classer en deux grands types :
- Les collisions. Les rayonnements vont entrer en collision avec les atomes présents dans le matériau. Les atomes du matériau sont considérés comme immobiles, alors que le rayon ne l'est pas. Le résultat est que l'impacteur va transférer une partie de sa quantité de mouvement à l'atome, ce qui le ralentit. Le rayonnement ralentit à chaque collision, ce qui le freine plus ou moins rapidement. Au bout d'un certain nombre de collisions, le rayonnement est ralenti. Plus la probabilité de collision est forte, plus le rayonnement ralenti. Précisément, tout dépend de la distance moyenne entre deux collisions (la longueur de libre parcours moyen). Plus les atomes sont proches, plus ce libre parcours moyen sera court et plus les collisions sont fréquentes. Cela fait que les matériaux denses sont de très bons ralentisseurs de rayons radioactifs.
- La répulsion électrostatique. D'autres processus sont liés à la répulsion électrostatique et agissent uniquement sur les particules chargées. Les rayonnements interagissent avec le champ électrique présent naturellement dans le matériau traversé, ce qui les ralentit. Par exemple, une particule bêta- (un électron) va être repoussé par les électrons présents dans le matériau, ce qui le freine rapidement. Même chose pour une particule alpha, qui sera repoussée par les noyaux atomiques du matériau. Par contre, un neutron ne sera pas freiné par ce mécanisme, vu qu'il n'est pas chargé. Ce processus est prédominant pour les particules chargées, la probabilité d'une collision étant assez "rare" (rappelons que la matière est composée à plus de 99% de vide).
La formule de Bethe
[modifier | modifier le wikicode]De manière générale, la distance de pénétration dépend des différences d'énergie cinétique entre rayonnements : plus un rayonnement est énergétique, plus il pénètre loin dans la matière. Le résultat est que les particules alpha sont celles qui pénètrent le moins dans la matière : non seulement elles sont massives, mais elles sont en plus bien chargées électriquement. Les particules bêta sont elles aussi arrêtées rapidement, surtout à cause de leur charge électrique (leur masse étant plus légère que celle d'une particule alpha). Les neutrons sont freinés essentiellement par les collisions, de même que les rayons gamma. La masse nulle et la forte énergie de ces derniers les rend plus difficiles à freiner que les neutrons, d'où leur fort pouvoir de pénétration.
Il existe une formule qui résume l'influence de ces éléments sur la profondeur de pénétration d'un rayonnement : la formule de Bethe. Celle-ci dit combien d'énergie cinétique une particule perd en parcourant une distance x dans le matériau freinant.
, avec c la vitesse de la lumière, 0 la permittivité électrique du vide, e et me la charge et la masse de l’électron, I une constante qui dépend du matériau et n la densité électronique du matériau freinant.
Il existe aussi une version relativiste de cette formule, que voici :
Les chambres à brouillard
[modifier | modifier le wikicode]Les collisions d'un rayon radioactifs sur un atome peuvent l'ioniser, s'ils sont assez énergétiques. Dans les faits, tous les rayonnements radioactifs sont des rayonnements ionisants (qui ionisent les atomes). Cette ionisation est à l'origine des dégâts de la radioactivité sur les tissus biologiques, comme nous le verrons plus tard. Mais c'est aussi grâce à ce phénomène que l'on peut détecter les rayons radioactifs. Pour cela, on utilise une chambre froide hermétique emplie de vapeur d'eau ou d'alcool diluée. La chambre est refroidie à une faible température, inférieure à 0 degré, histoire que la vapeur d'eau/alcool puisse se condenser en brouillard. Mais les conditions physiques dans la chambre sont telles que la vapeur ne peut se condenser spontanément. Il faut pour cela que la vapeur d'eau s’agglomère autour d'impuretés, qui font office de noyaux de condensation. L'ionisation induite permet justement de créer de telles impuretés. Lorsqu'un rayon radioactif cogne une molécule d'eau/d'alcool, elle peut l'ioniser. L'ion ainsi formé sert de noyau de condensation et donne naissance à une petite gouttelette d'eau/alcool. Le rayon radioactif donne naissance à plusieurs gouttelettes sur son trajet, ce qui donne une petite traînée de brouillard sur sa trajectoire. C'est ainsi que l'on peut détecter des rayonnements radioactifs.

L'interaction matière-rayons gamma
[modifier | modifier le wikicode]
Le cas des rayons gamma est un petit peu à part. Vu qu'il s'agit de lumière, ils sont absorbés lorsqu'ils traversent la matière. Quand on éclaire une surface, celle-ci absorbe une partie de la lumière qu'elle reçoit et les rayons gamma ne font pas exception. L'intensité de l'absorption dépend de plusieurs paramètres, dont les plus importants sont les suivants :
- L'épaisseur du matériau. L'absorption se fait progressivement sur le trajet de la lumière, une faible portion étant absorbée à chaque centimètre traversé. Plus le matériau est épais, plus le rayon gamma doit parcourir une grande distance avant de sortir du matériau et plus les opportunités d'absorptions sont grandes.
- Le nombre atomique, la taille des atomes. Intuitivement, plus les atomes du matériau sont gros, plus les rayons gamma ont de chance d'entrer en collision avec eux. Il se trouve que les atomes les plus gros sont ceux qui ont beaucoup d'électrons, et donc ceux qui ont un nombre atomique élevé.
- La densité du matériau. Plus un matériau est dense, plus ses atomes seront nombreux par unité de volume et plus les rayons ont de chance de les cogner sur leur trajet.
 |
 |
La loi de Beer-Lambert
[modifier | modifier le wikicode]Si on prend un bloc de matériau d'épaisseur , l'intensité en entrée et en sortie seront différentes. L'expérience montre que le rayonnement perd un pourcentage de son intensité, que nous noterons .
Il est raisonnable de supposer que l'absorption est constante pour une distance identique. Ce qui fait que l'on a, pour une distance infinitésimalement petite :
- , avec un coefficient appelé l'absorbance.
En intégrant pour une profondeur allant de 0 à x, on a :
La primitive du premier terme se calcule avec la formule suivante :
On utilise la formule :
En prenant l'exponentielle, on trouve l'absorption en fonction de la distance de pénétration. L'équation obtenue dit que l'absorption des rayons gamma est exponentielle avec la distance.
- , avec l'intensité à la surface du matériau.
On peut réécrire cette équation en utilisant le paramètre , qui peut s'interpréter comme la distance pour que l'intensité soit divisée par .
Cette équation de l'optique s'appelle la Loi de Beer-Lambert.
En utilisant cette équation, on peut démontrer que 95% de la lumière est absorbée à une distance de . On peut donc raisonnablement dire, en approximation, que la lumière ne pénètre que sur une distance bien précise, proche de . Cette distance n'est pas très grande pour les matériaux opaques, mais devient sensible pour les matériaux transparents. Pour les rayons gamma, beaucoup de matériaux sont transparents, ou presque transparents. Cela traduit que l'absorbance des matériaux est très faible pour les rayons gamma (mais pas forcément pour les autres formes de lumière).
Les mécanismes d'interaction rayons gamma-matière
[modifier | modifier le wikicode]L'absorption des rayons gamma est liée à divers mécanismes similaires à ceux mentionnés pour la matière. Vu que les rayons gamma ne sont pas chargés, seules les collisions avec les atomes peuvent les ralentir. On pourrait croire que leur nature lumineuse les empêche d'entrer en collision avec la matière, mais ce n'est pas le cas. Quand un rayon gamma cogne un atome, plusieurs phénomènes peuvent se produire : soit le photon rebondit sur l'atome, soit il l'ionise, soit un crée une paire électron-positron. Ces phénomènes s'appellent respectivement l'effet Compton, l'effet photoélectrique et l'effet de création de paires.
- L'effet Compton se manifeste quand la lumière rebondit sur l'atome impacté et lui transfère une partie de son énergie : le rayon gamma perd de l'énergie.

- L'effet photoélectrique se manifeste quand le photon gamma cogne un électron et lui transmet son énergie. L'électron acquiert assez d’énergie pour quitter l'atome, ce qui l'ionise.

- L'effet de création de paire fait que le photon se désintègre en une paire électron/positron. Cela peut arriver spontanément dans le champ électrique du solide traversé, ou alors suite à une collision avec un noyau atomique.

Le mécanisme dominant dépend fortement de l'énergie du photon gamma incident. Ci-dessous est illustré le mécanisme dominant en fonction de l'énergie du photon gamma.

Les désintégrations radioactives
On a vu dans le chapitre précédent que certains noyaux, dits instables, ont naturellement tendance à émettre des rayonnements pour perdre de l'énergie. Cette tendance s'appelle la « radioactivité » : est dit radioactif tout phénomène qui fait qu'un atome va émettre un rayonnement. Reste que cette radioactivité recouvre plusieurs phénomènes très différents : entre les noyaux qui émettent une particule alpha, des conversions de protons en neutrons et l'émission de rayons gamma, il y a de quoi faire. Dans les grandes lignes, on distingue trois types de radioactivité : la radioactivité gamma, la radioactivité alpha, la radioactivité bêta et ses sous-types. Comme vous l'avez deviné, elles se distinguent par les rayonnements émis : on parle de radioactivité alpha quand un noyau émet une particule alpha, de radioactivité bêta quand il émet un rayonnement bêta, et de radioactivité gamma quand le noyau émet du rayon gamma.
La désintégration alpha
[modifier | modifier le wikicode]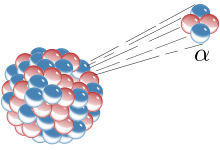
Avec la désintégration alpha, le noyau émet une particule alpha (qui contient deux protons et deux neutrons, pour rappel). Il s'agit d'un cas particulier de ce qu'on appelle la fission nucléaire (voir chapitre suivant), où un noyau se scinde en deux noyaux plus petit : ici, il se scinde en un noyau d'Hélium-4 et un autre noyau. Pour en donner un exemple, prenons celui de la désintégration alpha du noyau de Radium-226, qui se désintègre en un noyau de Radon-222 et une particule alpha.
On peut remarquer que le noyau final (pas la particule alpha, mais l'autre), a un nombre de masse inférieur de 4 à celui du noyau initial. Ce qui est normal, le 4 correspondant aux nucléons partis dans la particule alpha. En clair, la désintégration ne conserve ni le nombre de protons, ni le nombre de neutrons (et donc encore moins le nombre de masse).

Énergétique de la désintégration alpha
[modifier | modifier le wikicode]Si on fait la somme de la masse du noyau final et de la particule alpha, on ne retombe pas sur la masse du noyau initial, mais sur une masse un peu inférieure. De la masse a été perdue lors de la désintégration alpha, ce qui veut dire que de l'énergie a été libérée (de par l'équivalence masse-énergie). Cette énergie perdue provient d'un déficit d'énergie de liaison dans le noyau initial (rappelons que l'énergie de liaison est négative). Dit autrement, l'énergie de liaison (par nucléons) du noyau final est supérieure à l'énergie de liaison du noyau initial : la désintégration a fait évoluer le noyau initial sous une forme plus stable. Si on regarde bien, les désintégrations alpha ont lieu pour des noyaux qui ont un excès de nucléons, qui tend à les rendre instables.
La différence de masse se convertit en énergie cinétique et se répartit entre la particule alpha et le noyau. On peut comparer cela à un tir de pistolet : tout se passe comme si le noyau tirait une particule alpha. La particule alpha acquiert de l'énergie cinétique, de même que le noyau, qui recule sous l'effet du "tir". Initialement, le noyau est supposé immobile. La désintégration propulse la particule alpha dans une direction et le noyau final recule dans la direction opposée. Les quantités de mouvement de la particule alpha et du noyau final doivent donc être égales. On devine que la particule alpha va aller beaucoup plus vite que le noyau, vu qu'elle est beaucoup plus légère que le noyau, pour une même quantité de mouvement. Si on met la situation en équation, la conservation de la quantité de mouvement donne la formule suivante, avec la masse du noyau, la masse de la particule alpha, la vitesse du noyau et la vitesse de la particule alpha.
En réarrangeant, on a :
La conservation de l'énergie cinétique nous dit que l’énergie cinétique totale est la somme de l'énergie cinétique du noyau et de la particule alpha :
On ijecte alors l'équation dans la précédente :
Après quelques manipulations algébriques, on trouve :
On peut encore faire une autre approximation en supposant que la masse des noyaux est simplement proportionnelle au nombre de nucléons (masse du noyau = nombre de nucléons masse d'un nucléon). Les équations précédentes se simplifient alors :
Les calculs nous disent que la particule alpha emporte environ 98 % de l'énergie, laissant les maigres 2% de restes au noyau. Pour donner un exemple, la désintégration alpha du radium-226 en radon-222 libère approximativement 4,6 MeV. La raison est que le noyau final est beaucoup plus lourd que la particule alpha.
La loi de Geiger–Nuttall
[modifier | modifier le wikicode]La loi de Geiger–Nuttall est une loi physique qui relie la probabilité d'une désintégration alpha avec l'énergie cinétique des particules alpha émises. Pour faire simple, elle dit que plus un noyau a de chances de se désintégrer via une désintégration alpha, plus la particule alpha a de chances d'être énergétique. Une autre formulation est que les isotopes qui se désintègrent rapidement émettent des particules alpha très énergétiques.
La relation entre ces deux variables n'est pas linéaire. La première formulation mathématique de cette relation date de sa découverte, par Geiger et Nuttall, en 1911. Voici l'équation de l'époque :
- , avec Z le nombre de protons, E l'énergie cinétique de la particule alpha et la probabilité de désintégration alpha (la constante de temps de désintégration).
Le mécanisme de la désintégration alpha
[modifier | modifier le wikicode]Quelques observations laissent penser que le noyau a une structure interne, à savoir que les nucléons sont regroupés en paquets de nucléons fortement liés entre eux. Et les particules alpha sont justement des paquets de nucléons. Les particules alpha émises lors des désintégrations alpha sont déjà présentes dans le noyau avant la désintégration. Une désintégration a lieu quand une particule alpha préformée sort du noyau, s'en échappe.
La fuite d'une particule alpha du noyau arrive quand elle acquiert une énergie cinétique suffisante pour vaincre l'attraction nucléaire et sortir du noyau. L'énergie cinétique est acquise via la répulsion de Coulomb, la particule alpha étant repoussée par les autres protons du noyau. Plus un noyau est gros, plus il a de protons et plus la répulsion de Coulomb est forte. On en déduit donc que plus un noyau est gros, plus il a de chances de se désintégrer via désintégration alpha.
Les désintégrations bêta
[modifier | modifier le wikicode]
La radioactivité bêta se traduit par l'émission d'une particule bêta, qu'il s'agisse d'un électron ou d'un positron. Cette émission est toujours accompagnée par la transmutation d'un nucléon : soit un neutron devient un proton, soit c'est l'inverse. Le résultat est que le nombre de nucléons reste identique, alors que le nombre de protons ou de neutrons change. Pour le dire autrement, il s'agit d'une transformation qui transforme le noyau en un de ses isobares.
Un exemple est donné ci-contre, avec la désintégration bêta de l'iodine 131, qui devient du xénon 131 après émission d'une particule bêta. On voit que le nombre de masse reste le même : il est de 131 pour le Xénon-131 et l'Iodine-131. La différence se fait sur le nombre de protons et de neutrons : 53 pour l'Iodine-131, contre 54 pour le Xénon-131. L'atome a donc gagné un proton et perdu un neutron.
Comme autre exemple, on peut citer la désintégration bêta du Cobalt-60 en Nickel 60 :
La conversion d'un proton en neutron (ou inversement) pose un problème : la charge électrique et l'énergie doivent se conserver, alors que le neutron et le proton ont des charges et masses différentes. La conservation de la charge est garantie par l'émission d'un électron ou de son anti-particule, le positron. Lorsqu'un proton est créé à partir d'un neutron, un électron est produit en même temps afin de compenser la charge du proton. Dans le cas où un neutron est produit à partir d'un proton, un positron est créé en même temps pour compenser la perte de charge du nucléon transmuté. Si vous faites un bilan des charges, vous remarquerez que la charge est conservée : aucune charge n'est créée ni détruite. Pour cela, il faut impérativement que cette conversion fasse intervenir d'autres particules que les nucléons qui se transmutent.
Énergétique de la désintégration bêta
[modifier | modifier le wikicode]Logiquement, les calculs réalisés pour la désintégration alpha devraient marcher en remplaçant la particule alpha par l'électron, mais ce n'est pas le cas. L'énergie de masse du neutron n'est pas égale à la somme de celle du proton et de l'électron. Le problème est que la particule bêta émise a une énergie cinétique variable, comprise entre zéro et une valeur maximale. Par exemple, la désintégration bêta du Bismuth 210 crée des électrons dont l'énergie est comprise entre 0 et 1,15 électron-volts, avec une moyenne à 0,4 électron-volts. Si on fait le compte pour un grand nombre de désintégrations bêta, on obtient le graphique ci-dessous, appelé spectre bêta.

Cette observation est incompatible avec les calculs réalisés pour la désintégration alpha, qui prévoient que l'énergie cinétique de l'électron ne peut prendre qu'une valeur unique. Pour résoudre ce problème, Pauli a théorisé qu'une partie de l'énergie partait dans une autre particule, produite par la désintégration et émise en plus de la particule bêta. Cette particule a été appelée neutrino et anti-neutrino, suivant que la transmutation soit proton->neutron ou neutron->proton. Pauli a déterminé sa masse à partir du spectre bêta et de quelques calculs théoriques, et a établi que le neutrino doit avoir une charge nulle (d'après la conservation de la charge). Cette prédiction a été confirmée par la découverte du neutrino, avec la masse et la charge identique à celle calculée par Pauli.
Les types de désintégration bêta
[modifier | modifier le wikicode]
On distingue plusieurs types de radioactivité bêta, appelées radioactivité bêta plus, bêta moins et capture électronique.
- Avec la radioactivité bêta plus, un proton se transforme en un neutron, un positron et un neutrino.
- Avec la radioactivité bêta moins, un neutron se transforme en un proton, un électron et un anti-neutrino.
- Avec la capture électronique, un électron du cortège électronique interagit avec un proton du noyau et se transforme en neutron et un neutrino.
 |
 |
Le cas de la capture électronique est un peu particulier, qui est plus rare que les autres formes de désintégration bêta. Lorsqu'elle se produit, un électron du cortège atomique disparaît, laissant un trou dans le cortège électronique. Ce dernier se réorganise, certains électrons changeant de place (d'orbitale, pour les puristes) pour combler le vide laissé par leur défunt camarade. Ce changement de place leur fait perdre de l'énergie, qui est évacuée de l'atome sous la forme d'un photon Auger.
L'origine des désintégrations bêta : l'interaction faible
[modifier | modifier le wikicode]Les désintégrations bêta font intervenir la transformation d'un proton en neutron ou la réaction inverse. Cette transformation est régie par une interaction particulière, appelée l'interaction faible. C'est une des quatre forces fondamentales de la nature, avec la gravité, l'électromagnétisme et la force forte. Elle n'intervient que dans les désintégrations nucléaires et quelques autres phénomènes mineurs. Les particules qui interagissent avec l'interaction faible sont nombreuses, mais le cas le plus important pour ce qui nous intéresse est celui des quarks.
Pour rappel, il existe plusieurs types de quarks, nommés up, down, bottom, top, strange et charm. L'interaction faible a le pouvoir de changer le type des quarks, comme le montre l'exemple de la transformation proton-neutron, où un up est transformé en down (ou inversement). Les diagrammes ci-contre et ci-dessous (pas très faciles à lire, vous m'excuserez) montrent toutes les désintégrations possibles d'un quark vers un autre. On voit que les quarks sont répartis en deux classes : les down, strange et bottom d'un côté et up, charm et top de l'autre. Un quark peut se transformer en tous les membres de l'autre classe, mais ne peut pas se désintégrer en un quark de la même classe que lui.

Le lien avec les désintégrations bêta est que les protons et neutrons sont composés de quarks, des particules chargées de petite taille. Un proton contient deux quarks up et un quark down, alors qu'un neutron contient deux down et un up. Les transmutations de proton à neutron doivent modifier la composition des quarks : un quark up doit se transformer en down ou inversement. Si un quark up d'un proton se change en down, on obtient un neutron (et inversement pour le passage d'un neutron à un proton).
Les particules interagissent (par interaction faible) en s'échangeant des particules qui servent d'intermédiaires : les bosons , et . Par exemple, la transformation d'un quarks up en down entraîne l'émission d'un boson , comme illustré ci-dessous. C'est ce boson qui se désintègre en une paire électron-neutrino, émise lors de la désintégration bêta-. L'émission de tels boson est nécessaire pour conserver la charge, la masse et l'isospin. Dans l'exemple de la désintégration bêta, les quarks up et down n'ont ni la même masse, ni la même charge (mettons de côté l'isospin). La différence entre les deux doit être compensée par l'émission ou l'absorption d'un boson d'interaction faible.

Annexe : les réactions bêta inverse
[modifier | modifier le wikicode]Les réactions bêta inverse sont des réactions nucléaires semblables à la désintégration bêta, à savoir qu'elles transforment un proton en neutron ou inversement. Mais le processus est totalement différent et implique l'interaction entre un nucléon et un neutrino/anti-neutrino. Il ne s'agit pas de réactions spontanées et imprévisibles, mais de réactions qui demandent une collision entre deux particules, suivie par une interaction spécifique.
Il existe trois réactions de ce genre. La première transforme un proton en neutron. Le proton absorbe un anti-neutrino électronique, et le tout donne un neutron accompagné de l'émission d'un anti-électron.
La seconde réaction fait l'inverse et transforme un neutron en proton. Elle se caractérise par l'absorption d'un neutrino électronique et l'émission d'un électron.
Notons que ces réactions sont possibles seulement si les neutrinos ont beaucoup d'énergie, et ce pour deux raisons. La première est que plus un neutrino est énergétique, plus il interagit avec la matière. Oubliez ces histoires de neutrinos qui traversent tout, qui sont souvent mentionnées dans la vulgarisation : c'est l'inverse quand la température est trop forte, les neutrinos sont tellement énergétiques qu'ils interagissent à mort avec tout ce qui passe. De plus, la réaction n'est possible que si le neutrino incident a assez d'énergie pour compenser la différence de masse entre les produits et les réactifs de la réaction nucléaire.
En pratique, de telles réactions ne sont observées que dans des contextes assez précis, et presque jamais sur Terre. Des expériences assez onéreuses, qui visent à mesure le flux de neutrinos provenant du Soleil, utilisent ces réactions pour détecter les neutrinos arrivant, mais avec un taux de détection extrêmement bas. Dans la nature, les réactions bêta inverse sont surtout observées dans les supernovæ et quelques autres évènements astrophysiques extrêmes. Elles étaient aussi très courantes quelques secondes ou minutes après le big-bang, quand la température était extrême. Les neutrinos étaient tellement énergétiques qu'ils interagissaient avec la matière très fréquemment, avec un équilibre entre réaction bêta inverse et désintégrations bêta. Mais avec la baisse de température, les neutrinos ont cessé d'interagir avec la matière et il s'est produit un découplage semblable à ce qui s'est passé pour les photons. Mais ceci est une autre histoire, qui d'ailleurs abordé dans un des chapitre du wikilivre de cosmologie.
La désintégration gamma
[modifier | modifier le wikicode]
La radioactivité gamma correspond au cas où un noyau émet un photon pour se débarrasser d'un surplus d'énergie. Le rayonnement gamma émis possède presque systématiquement une grande énergie, ce qui fait qu'il appartient à la classe des rayonnements gamma : la radioactivité gamma tient son nom de là. Elle peut avoir lieu de manière spontanée, mais elle a surtout lieu immédiatement après une désintégration alpha ou bêta : le noyau nouvellement formé contient un surplus d'énergie qu'il évacue sous la forme d'un photon.
Pour en donner un exemple, prenons le cas de la désintégration bêta du Cobalt-60 en Nickel 60 :
Après la désintégration bêta, le noyau de Nickel-60 contient un surplus d'énergie, provenant de sa forme originelle (l'atome de Cobalt). Il s’empêche alors de l'évacuer en émettant un photon, afin de redescendre vers son niveau d'énergie minimal (son état fondamental).
Les types de désintégration gamma
[modifier | modifier le wikicode]Il en existe deux grands types :
Si le photon quitte l'atome, on parle de transition isomérique : c'est de loin le cas le plus fréquent. Ce nom provient du fait que l'atome est transformé en un de ses isomères nucléaire : il passe d'un isomère nucléaire à un autre, suite à une désintégration gamma.
Il arrive que le photon émis soit absorbé par un électron de l'atome et lui transmette son énergie. L’électron ainsi surchargé en énergie peut quitter l'atome, ce qui l'ionise : on parle alors de conversion interne. Pire : une fois que l'électron a été émis, un réarrangement des électrons dans l'atome a lieu, ce qui peut mener à l'émission de nouveaux photons, appelés photons Auger. Plus un atome a d'électrons, plus cela a de chances d'arriver. À noter que, formellement, les conversions internes sont un cas particulier de radioactivité bêta et non de radioactivité gamma.
L'énergie fournie à l'électron est égale à l'énergie du photon gamma, à laquelle on retranche l'énergie de liaison de l'électron à l'atome (l'énergie d'ionisation associée à cet électron). Cette énergie de liaison est quantifiée du fait de l'existence de niveaux d'énergie pour les électrons. Sachant que l'énergie du photon gamma l'est aussi, l'énergie finale de l'électron est donc quantifiée : les électrons émis par conversion interne ont donc une énergie bien précise, qui ne peut prendre que certaines valeurs. C'est grâce à cela qu'on les distingue des électrons émis par désintégration bêta-, dont l'énergie cinétique est sur un continuum.
Le processus physique à l'origine de la désintégration gamma
[modifier | modifier le wikicode]La radioactivité gamma est causée par un phénomène physique particulier, qui est lié à l'énergie du noyau. Tout noyau possède une certaine quantité d'énergie, énergie qui peut varier suivant la situation. Mais un noyau est une particule très petite : à de telles échelles, les lois de la physique à utiliser sont les lois de la physique quantique. Sans rentrer dans les détails, ces lois disent que l'énergie d'un noyau ne peut évoluer que par paliers, à partir d'une énergie minimale. Dit autrement, seules certaines valeurs d'énergie sont autorisées. L'énergie d'un noyau monte d'un palier en absorbant de l'énergie extérieure, par exemple en absorbant un photon. Il arrive aussi que l'énergie d'un noyau descende d'un palier, la différence d'énergie se transformant en un photon : on dit que le noyau se désexcite. C'est ce phénomène de désexcitation qui permet au noyau d'émettre des photons gamma.
Résumé
[modifier | modifier le wikicode]
On vient de voir qu'il existe différents types de radioactivité, qui se caractérisent pas l'émission d'une particule alpha, bêta ou gamma. Il en existe plusieurs types, résumés dans le tableau ci-dessous. Chaque type de radioactivité correspond à une situation où :
- le nombre de masse est conservé, de même que le nombre de protons (radioactivité gamma) ;
- le nombre de masse est conservé, mais pas le nombre de protons (radioactivité bêta) ;
- ni le nombre de masse, ni le nombre de protons ne sont conservés (radioactivité alpha).
À ces trois formes de radioactivité, on peut ajouter le cas où un noyau perd un neutron ou un proton. L'émission d'un proton et d'un nucléon ne conserve pas le nombre de masse (mais qui conserve Z dans le cas de l'émission d'un neutron).
| Radioactivité gamma |
|
A et Z inchangés : Nombre de masse et de protons conservés |
|---|---|---|
| Radioactivité bêta |
|
A inchangé, mais Z réduit ou augmenté d'une unité. |
| Radioactivité alpha | Pas de sous-type | A réduit de quatre unités et Z de 2 unités. |
| Émission d'un nucléon | Émission d'un proton | A et Z réduits d'une unité. |
| Émission d'un neutron | A réduit d'une unité, Z inchangé. |
La radioactivité alpha permet d'éliminer des nucléons de noyaux trop lourds, trop chargés en nucléons. Rappelons en effet que l'énergie de liaison par nucléons est assez faible pour les noyaux lourds. Qui plus est, elle baisse régulièrement avec le nombre de nucléons, jusqu’à atteindre un minimum pour le Fer-56. Les noyaux plus lourds que le Fer-56 vont donc tenter de réduire leur nombre de nucléons, pour devenir du Fer-56. La radioactivité alpha est justement un des processus qui le leur permet. Quant à la radioactivité bêta, elle permet d'éliminer un excès soit de protons, soit de neutrons. La radioactivité bêta plus permet aux noyaux de se débarrasser d'un excès de protons, alors que la bêta moins lui permet d'éliminer un excès de neutrons.
Rappelons que les noyaux les plus stables ont approximativement autant de protons que de neutrons (modulo l'effet de la répulsion électrostatique). Les conséquences sont visibles sur le graphique N-Z, qui illustre la vallée de stabilité. On voit que les noyaux qui ne se désintègrent pas sont placés sur une courbe, qui correspond approximativement à la droite . Les noyaux situés au-dessus de cette droite ont un excès de neutrons, qu'ils éliminent pas désintégration bêta moins, alors que ceux en dessous ont un excès de protons qu'ils éliminent pas désintégration bêta plus. La désintégration alpha n'a lieu que pour des noyaux suffisamment lourds, au-delà d'un Z=56. Mais d'autres mécanismes permettent aux noyaux instables de se transmuter en noyaux plus stables. Mais ces processus de fission nucléaire et d'émission d'un nucléon seront vus dans le chapitre suivant.

L'émission et la capture de nucléons
Dans ce chapitre, nous allons aborder les situations où un noyau absorbe ou émet un nucléon. On peut les classer en plusieurs types, qui sont décrits ci-dessous.
- La capture d'un nucléon correspond à l'absorption d'un nucléon isolé par un noyau. Le nombre de masse augmente d'une unité, Z augmentant si le nucléon est un proton.
- La capture de proton est un cas particulier de fusion nucléaire (deux noyaux fusionnent pour n'en former qu'un seul), où un noyau fusionne avec un noyau d'hydrogène.
- La capture de neutron est un cas particulier de fusion nucléaire, où un noyau fusionne avec un neutron isolé.
- L'émission d'un nucléon se traduit par l'émission d'un ou plusieurs nucléons par le noyau.
- L'émission d'un proton peut être vue comme un cas particulier de fission nucléaire (un noyau qui se casse en deux), où l'un des noyaux résultant est un noyau d'hydrogène.
- L'émission d'un neutron, quant à elle, ne peut pas être vue comme un cas particulier de fission nucléaire (un neutron isolé n'est pas un noyau).
| Proton | Neutron | |
|---|---|---|
| Émission | Émission protonique | Émission neutronique |
| Capture | Capture protonique | Capture neutronique |
L'émission de nucléons
[modifier | modifier le wikicode]L'émission de nucléons se traduit par la réduction du nombre de masse du noyau d'au moins une unité. Le noyau peut émettre soit un nucléon (un proton ou un neutron), soit en émettre deux à la fois. S'il n'émet qu'un seul nucléon, on parle d'émission simple. S'il en émet deux à la fois, on parle de double émission. Les doubles émissions sont rares, bien plus que les émissions simples (déjà elles-mêmes peu fréquentes). Le nucléon émis peut être un proton ou un neutron :
- Avec une émission de proton, à la fois A et Z sont réduits d'une unité.
- Avec une émission de neutron, A est réduit d'une unité alors que ce n'est pas le cas de Z.
- Avec l'émission d'un neutron, le noyau est transformé en un de ses isotopes.
Énergétique de l'émission d'un nucléon
[modifier | modifier le wikicode]Le noyau est plus stable après avoir émis un proton ou un neutron, ce qui veut dire qu'il a perdu de l'énergie. Cette énergie, libérée par la réaction, se répartit entre le proton et le noyau final. L'application de la conservation de la quantité de mouvement nous permet de déterminer comment se fait cette répartition (le raisonnement est similaire à celui donné dans la section sur la radioactivité alpha). On trouve alors les deux équations suivantes, avec et l'énergie cinétique et la masse du noyau final, et et celles du proton/neutron émis.
On a alors :
Le mécanisme de l'émission de nucléons
[modifier | modifier le wikicode]L'émission d'un nucléon regroupe plusieurs phénomènes différents, dont les mécanismes ne sont pas les mêmes.
- Dans le premier cas, l'émission est spontanée. Le noyau peut être excité, mais il est la plupart du temps dans son état d'énergie minimale. Pour une émission spontanée, il faut que le noyau ait un excès ou un déficit de neutrons/protons et l'émission lui permet de s'en débarrasser. C'est pourquoi on parle d'émission radioactive de nucléon.
- Le second cas est celui d'une fission nucléaire (un noyau qui se casse en deux) qui laisse échapper un nucléon. Certains isotopes se fragmentent en noyaux plus simples, en émettant un neutron lors de la fission. Il existe la même chose avec la fusion nucléaire (deux noyaux fusionnent en un noyau plus gros). Deux noyaux qui fusionnent peuvent donner naissance à un noyau excité, qui se désintègre en émettant un nucléon. Ces deux types d'émission nucléique sont appelée émission nucléique induite par une fission/fusion. En général, les noyaux avec beaucoup de neutrons par rapport aux protons émettent des neutrons, alors que ceux avec un excès de protons émettent des protons.
- Le troisième type d'émission nucléique fait suite à une désintégration bêta, qui laisse un noyau dans un état excité (surchargé en énergie). L'excès d'énergie est supérieur à l'énergie nécessaire pour éjecter un nucléon, et sert donc à éjecter un neutron ou un proton du noyau. On parle alors d'émission bêta-retardée. Ce cas de figure est de loin le plus courant : plus de 160 noyaux capables d'émission retardée ont été identifiés à ce jour, contre moins de 47 pour le second phénomène.
- Avec le dernier mécanisme, l'émission d'un nucléon est induite par l'absorption d'un photon gamma : le noyau passe en état excité et se désexcite en émettant un nucléon. Ce phénomène est appelé la photodésintégration, ce qui signifie désintégration radioactive induite par un photon. Un exemple est la transformation du Deutérium en Protium suite à l'absorption d'un photon gamma :
L'émission radioactive de nucléons a lieu pour des noyaux en excès ou déficit de protons/neutrons. Un noyau qui possède un excès en neutron va en éjecter un ou deux de son noyau, tandis qu'un noyau avec un excès de protons va en expulser un ou deux de son noyau. Vu que seul un ou deux nucléons sont évacués du noyau, on se doute que ces noyaux sont très proches de la situation d'équilibre, approximativement Z = N. Sur le graphique Z-N, ils sont très proches de la limite de stabilité, la droite qui identifie les noyaux stables dans la vallée de stabilité. Cependant, l'émission d'un nucléon est un processus assez rare. Il faut dire qu'un noyau avec un excès de protons/neutrons peut s'en débarrasser par radioactivité bêta.
Le mécanisme qui se cache derrière l'émission radioactive (spontanée) d'un nucléon est l'équivalent de la radioactivité alpha, mais pour un nucléon seul. D'ailleurs, les théories qui expliquent l'émission de nucléons sont les mêmes que celles qui rendent compte de la radioactivité alpha. Pour les résumer, le nucléon est préformé dans le noyau, où il s'y déplace comme bon lui semble. Il s'échappe du noyau quand il acquiert une énergie cinétique suffisante, qui surpasse l'attraction nucléaire.
- L'émission d'un proton est censée être plus probable : sa charge entraîne une répulsion électrostatique, qui le propulse plus facilement que le neutron.
Les sources de neutrons et de protons
[modifier | modifier le wikicode]Certaines expériences en physique nucléaire et en physique des particules ont besoin d'une source de neutron stable. Par source de neutrons, on désigne quelque chose qui émet des neutrons, peu importe par quel mécanisme. Les sources de neutrons sont utilisées en-dehors des expériences de physique, en médecine dans certains appareils d'imagerie médicale, dans l'industrie, etc. Si le terme est assez général, elles ne fonctionnent pas toutes de la même manière. Certaines utilisent la fission, d'autres l'émission bêta-retardée, etc.
Les sources de nucléons à particules alpha
[modifier | modifier le wikicode]Les premières sources de neutrons à avoir été inventées utilisaient du Béryllium. L'isotope stable du Béryllium, le Beryllium-9, possède un neutron assez peu lié au reste du noyau (son énergie de liaison est d'à peine 1,7 MeV). Si on fait fusionner ce noyau avec une particule alpha, il forme un atome de Carbone stable en émettent un neutron. La réaction nucléaire en question est la suivante :
Si on couple du Béryllium-9 avec une source de particule alpha, on obtient une source de neutrons. SI on veut de plus que la source assure un débit régulier, il faut que la source de particules alpha ait une longue demi-vie, comme du , du , du , du , ou du . Mais si le débit est régulier, l'énergie des neutrons émis n'est pas si stable et varie grandement d'un neutron à l'autre. C’est lié au fait que les énergies des particules alpha sont assez dispersées, qu'elles sont ralenties de manière stochastique en parcourant un solide (ici, le Béryllium et la source), et quelques autres raisons.
Un mécanisme similaire permet de créer des protons très énergétiques, en remplaçant le béryllium par de l'Azote-14. En bombardant de particules alpha de l'Azote-14, ce dernier absorbe la particule alpha et se désintègre en Oxygène-18 en émettant un proton. Les réactions sont les suivantes :

Les sources de nucléons par photodésintégration
[modifier | modifier le wikicode]Une autre possibilité est d'utiliser la photodésintégration. L'avantage de cette technique est que l'énergie des neutrons est plus simple à contrôler, vu qu'il existe des sources de lumière qui délivrent une énergie/intensité assez stable/constante. Pour cela, on peut encore une fois utiliser du Béryllium-9, que l'on couple à une source constante de rayons gamma. La source de rayons gamma est parfois du , qui émet des particules gamma de 2,76 MeV. Le Béryllium absorbe ces rayons gamma et se désintègre en Béryllium-8. L'énergie du neutron émis est d'environ 0.8 MeV. La réaction est la suivante :
Les générateurs de protons/neutrons
[modifier | modifier le wikicode]On peut aussi utiliser la fission ou la fusion de certains isotopes. Par exemple, cela fonctionne avec le , qui émet 4 neutrons par fission. Mais de telles réactions sont difficiles à contrôler. Induire une fission ou une fusion demande d'avoir un accélérateur de particules ou un réacteur nucléaire à disposition. Les générateurs de neutrons sont des sources de neutrons qui contiennent un accélérateur de particule qui induit la fusion de deux noyaux. Les plus simples font fusionner des isotopes de l'hydrogène, comme du deutérium et du tritium. Les réactions en question sont les suivantes, avec D pour le deutérium et T pour le tritium :
- , le neutron émit a une énergie de 14.1 MeV.
- , le neutron émit a une énergie de 2.5 MeV.
La capture de nucléons
[modifier | modifier le wikicode]La capture d'un nucléon a lieu quand un nucléon isolé rentre dans un noyau atomique et fusionne avec lui. Par contre, les captures de nucléons peuvent être annulées par photodésintégration : le noyau absorbe un photon et passe en état excité instable, avant de désintégrer en émettant un nucléon. La concentration en noyaux formés par capture de nucléon dépend des apports mais aussi des pertes. Les apports dépendent seulement de la fréquence des captures, les pertes sont causées par les photodésintégrations. Les deux processus sont favorisés par la température, ce qui fait qu'il existe une température optimale où les noyaux formés par capture sont les plus abondants.
La capture d'un proton est plus difficile que celle d'un neutron, en raison de la répulsion électrostatique. Le proton est repoussé par le noyau et ne peut le toucher qu'au prix d'un apport d'énergie assez important, alors que le neutron n'a pas ce problème, vu qu'il n'est pas chargé et donc non-soumis à la répulsion électrostatique du noyau. La conséquence est que la capture protonique ne s'observe que dans des environnements très chauds, où les protons ont une énergie cinétique très importante. Plus l'environnement est chaud, plus les captures protoniques sont fréquentes.
Il faut noter que la capture protonique transforme un noyau d'un élément chimique en un autre. Ce qui n'est pas le cas avec la capture neutronique, qui transforme le noyau en un de ses isotopes. Le noyau obtenu après fusion a un nucléon de plus que le noyau initial : son nombre de masse augmente, et son nombre atomique peut aussi changer lors de la capture d'un proton.
- Avec la capture d'un proton, un noyau voit A et Z augmenter tous d’une unité.
- Avec la capture d'un neutron, le noyau voit son nombre de masse A augmenter d'une unité, alors que Z reste le même.
Les réactions nucléaires induites par capture neutronique
[modifier | modifier le wikicode]La capture d'un neutron donne naissance à un nucléide instable qui se désintègre rapidement, pour éliminer l'énergie apportée par la fusion. Pour cela, le noyau peut émettre un photon gamma, émettre un nucléon (de préférence le même que celui absorbé), ou fissionner (c'est à dire qu'il éclate en plusieurs noyaux séparés). Selon la méthode de désintégration/fission du noyau, on distingue plusieurs réactions :
- La réaction (n,) : le noyau capture un neutron, puis subit une désintégration gamma.
- La réaction (n,p) : le noyau capture un neutron, puis émet un proton.
- La réaction (n,2n) : le noyau capture un neutron, puis en émet plusieurs. La réaction la plus courante est la réaction (n,2n) où le noyau émet deux neutrons différents - c'est celle-ci qui est mise en équation ci-dessous. Il arrive plus rarement que le noyau émette non pas deux, mais 3, 4, 5 ... bref : plusieurs neutrons.
- La réaction (n,) : le noyau capture un neutron, puis subit une désintégration alpha.
- La réaction (n,f) : le noyau capture un neutron, puis subit une fission (il se casse en deux noyaux plus petits).
Les réactions en chaine : bombes atomiques et réacteurs nucléaires
[modifier | modifier le wikicode]La réaction (n,2n) est de loin la plus intéressante, vu que l'une d'entre elle est utilisée dans les réacteurs nucléaires pour produire de la chaleur et de l’électricité. Il s'agit de l'exemple classique de la fission induite de l'Uranium-235. Quand celui-ci capture un neutron, il se transforme en Uranium-236 instable, qui fissionne. Le résultat de la fission est un noyau de Barium-141, un noyau de Krypton-32 et deux à trois neutrons. Les neutrons émis lors de cette fission peuvent eux aussi être capturés par des noyaux environnants, et le processus recommence. Au final, on obtient une suite de réactions en chaîne qui s'auto-entretiennent.
 |
 |
La réactivité
[modifier | modifier le wikicode]Le comportement de la réaction en chaîne peut se résumer avec un paramètre appelé la réactivité, noté . Grossièrement, c'est un paramètre qui dit si la réaction s'emballe exponentiellement, reste stable comme dans un réacteur, ou ralentit jusqu'à finir par cesser complètement.
- Si , la réaction s'emballe exponentiellement ;
- Si , la réaction est stable ;
- Si , la réaction ralentit progressivement et cesse après un certain temps.
Pour comprendre ce qu'est la réactivité, nous devons introduire le concept de génération de neutron. Pour cela, partons d'une situation où N neutrons sont émis par désintégration de l'Uranium : c'est la première génération de neutrons. Sur ces n neutrons, certains vont être absorbés par des noyaux d'Uranium, d'autres non. Ceux absorbés vont entraîner une désintégration et entraîner l'émission de nouveaux neutrons : ces neutrons forment la seconde génération de neutrons. Et ainsi de suite : certains de ces neutrons vont être absorbés par l'Uranium et donner naissance à de nouveaux neutrons, de troisième génération, etc. Plusieurs générations de neutrons vont se succéder ainsi, chacun étant créée par un ensemble de désintégrations. La réactivité est définie par la différence entre nombre de neutrons produit lors d'une génération et nombre de neutrons produits à la génération suivante. Si on note le nombre de neutrons de génération , on a :
Si on suppose qu'il est constant (ce qui est souvent une bonne approximation, on trouve rapidement que :
- , avec le nombre de neutrons émis en première génération.
Si , le nombre de neutrons augmente ou diminue exponentiellement (en suivant une loi de puissance, pour être précis). Mais si , le nombre de neutrons (et donc de désintégrations) reste stable.
Bombes atomiques et réacteurs nucléaires
[modifier | modifier le wikicode]Les réactions en chaîne sont utilisées dans les bombes atomiques, mais aussi dans les réacteurs nucléaires. La différence tient dans la réactivité : supérieure à 1 pour une bombe nucléaire, égale ou légèrement inférieure à 1 pour un réacteur nucléaire.
Si le matériau atteint une certaine masse, appelée masse critique, on a et le nombre de neutrons augmente exponentiellement. Chaque désintégration donne plusieurs neutrons, qui sont absorbés par des atomes d'Uranium, qui eux-mêmes donnent plusieurs neutrons et ainsi de suite. Le nombre de désintégrations augmente alors de manière exponentielle avec le temps, qui ne s’arrête qu'une fois tout l'Uranium consommé. Chaque désintégration libère de l'énergie, ce qui fait que la réaction en chaîne entraîne une énorme production d'énergie incontrôlée. Ce n'est ni plus ni moins ce qui se passe dans une explosion nucléaire.

Un réacteur nucléaire utilise l'énergie des désintégrations de l'Uranium pour chauffer de l'eau. Un réacteur nucléaire utilise le même principe que la réaction en chaîne, sauf qu'on limite le nombre de désintégrations pour éviter qu'il ne croisse exponentiellement. Pour cela, on doit faire en sorte que la quantité de neutrons en circulation reste plus ou moins constante : chaque neutron donne naissance en moyenne à un neutron, qui lui-même donne naissance à un nouveau neutron et ainsi de suite. En clair, sur les deux neutrons émis par une désintégration de l'Uranium, l'un doit être retiré de la circulation et ne doit pas interagir avec un atome d'Uranium. Tout cela implique de retirer des neutrons de la circulation et les absorber. Pour ceci, on utilise des matériaux absorbants qui absorbent des neutrons. Ainsi, on garantit que le nombre de neutrons n'augmente pas exponentiellement, ce qui calme la réaction en chaîne. L'absorption des neutrons n'est autre qu'une réaction de capture neutronique de type (n,) entre le matériau modérateur et le neutron. Comme matériau absorbant, on utilise de l'Hydrogène pour les neutrons rapides, et du Cadmium pour absorber les neutrons "lents" :
En outre, le réacteur fait aussi en sorte que la plupart des neutrons soit ralentis. Les neutrons lents sont appelés de neutrons thermiques et ont une énergie cinétique inférieure à 0,025eV et une vitesse inférieure à 2 190 m/s. Il faut dire que les neutrons lents ont plus de chance de fusionner avec des atomes d'Uranium, contrairement aux neutrons rapides. Soit ils quittent le réacteur trop rapidement pour interagir avec l'Uranium, soit ils ne déclenchent pas de fission après capture. Le ralentissement des neutrons s'effectue avec un matériau dit modérateur, sur lequel les neutrons vont se cogner. À chaque collision, le neutron va céder une partie de sa vitesse à l'atome qu'il cogne, ce qui va le ralentir. Au fur et à mesure des collisions, le neutron va progressivement ralentir, jusqu’à devenir un neutron thermique.
Les processus R, S, P et RP
[modifier | modifier le wikicode]Dans un autre registre, la capture de neutrons et de protons est impliquée dans la formation de certains éléments chimiques plus lourds que le Fer. En effet, tous les éléments plus lourds que le Fer, avec plus de nucléons, sont instables. Ils tendent à se désintégrer par radioactivité ou par fission en noyaux plus légers. Cela explique pourquoi ces éléments sont rares, mais pose un problème. En effet, une quantité infinitésimale de ces éléments a été synthétisée après le Big-Bang et leur quantité devrait avoir diminuée depuis à cause des désintégrations. Mais si on fait le compte, les éléments lourds sont bien plus nombreux que ce que les calculs nous disent. La seule explication est que ces éléments lourds se sont synthétisés après le Big-Bang, par des mécanismes encore assez mal compris. On ne sait pas très bien où a lieu cette synthèse : dans les supernovas, dans les étoiles massives, dans les centres galactiques, ailleurs ? Par contre, on sait que leur synthèse est réalisée par des réactions de capture de nucléons, appelées processus R, S, P et RP.
Les processus S et R sont des processus de capture de neutrons, alors que les processus P et RP sont des processus de capture de protons. Les processus de capture neutronique (S et R) donnent des noyaux très riches en neutrons, bien éloignés de la ligne de stabilité. Même chose pour les processus de capture protonique (P et RP), qui donnent des noyaux riches en protons, avec peu de neutrons.
Une autre différence tient dans la vitesse des captures, le temps d'attente entre deux captures. On distingue ainsi les processus où deux captures successives sont temporellement éloignées et ceux où les captures s’enchaînent rapidement.
- Pour les processus R et RP, les captures de nucléons s’enchaînent suffisamment rapidement pour que les noyaux obtenus n'aient pas le temps de se désintégrer entre deux captures. Cela se produit quand le flux de nucléons est très important, ce qui signifie qu'il faut une source de nucléons très active. La source a donc une température très élevée, de plusieurs millions de degrés au minimum. On suppose que ces réactions peuvent avoir lieu dans les supernovas, durant lesquelles les flux de particules sont certes très brefs (quelques secondes) mais sont aussi très intenses.
- Pour les processus S et P, les nucléons sont absorbés lentement et les noyaux obtenus ont le temps de se désintégrer entre deux captures. Ici, le flux de nucléons est plus lent, moins soutenu, ce qui signifie que la source de nucléons a une température bien plus basse.
La distinction entre processus lents et rapide est de première importance et explique les résultats différents entre les deux processus. Pour les processus lents P et S, certains noyaux formés ne sont pas stables et subissent très souvent des désintégrations bêta. Le processus d'ajout de nucléons se poursuit alors sur un noyau différent, produit par désintégration bêta. Cela n'arrive pas aussi fréquemment avec les processus rapides R et RP, pour lesquels les désintégrations bêta sont plus rares (mais elles existent). Les deux processus peuvent partir du même élément, mais donner des éléments très différents.
| Vitesse de capture\Nucléon capturé | Neutron | Proton |
|---|---|---|
| Lente | Processus S (Processus de capture neutronique lent - slow neutron-capture process) | Processus P (Processus de capture protonique rapide - slow proton-capture process) |
| Rapide | Processus R (Processus de capture neutronique rapide - rapid neutron-capture process) | Processus RP (Processus de capture protonique rapide - rapid proton-capture process) |
Un exemple est celui du processus S, un processus de capture de neutrons, illustré ci-dessous. On voit qu'il commence à l'Argent, mais que diverses désintégrations bêta lui permette de créer des noyaux de Cadmium, d'Indium, d’Étain, d'Antimoine, et ainsi de suite.
 |
 |
Les réactions nucléaires

Les réactions nucléaires sont des transformations de noyaux atomiques et/ou de nucléons. Lors d'une telle réaction, des noyaux et des nucléons interagissent pour donner d'autres noyaux/nucléons. Par exemple, un noyau peut se transformer en un ou plusieurs autres noyaux. Les désintégrations radioactives sont formellement des réactions radioactives, qui font passer un nucléide vers un autre. Mais il existe d'autres formes de réactions entre noyaux dont nous n'avons pas parlé dans le chapitre précédent. Elles portent les doux noms de fission et de fusion nucléaire. On peut aussi rajouter les réactions de diffusion nucléaire, que nous verrons dans le chapitre suivant.
- La fission nucléaire correspond au cas où un noyau se scinde en plusieurs noyaux plus petits.
- La fusion nucléaire a lieu quand des noyaux fusionnent ensemble pour former un noyau plus gros.
Le mécanisme derrière ces réactions nucléaires est lié à l'énergie de liaison. Rappelons que l'énergie de liaison par nucléon dépend du noyau : les noyaux légers accusent un manque d'énergie de liaison, de même que les noyaux trop lourds. Un minimum d'énergie est obtenu pour le Fer-56, qui est l’élément le plus stable de tous. Les différents noyaux, moins stables que le Fer, vont alors tenter de gagner ou de perdre des nucléons pour s'en rapprocher. Si les noyaux légers se rapprochent du Fer-56 en gagnant des nucléons, ce qui est possible en fusionnant avec d'autres noyaux légers (phénomène de fusion nucléaire). Par contre, les noyaux lourds s'en rapprochent en perdant des nucléons, que ce soit par désintégration alpha, par émission nucléaire ou par fission nucléaire.

À noter que la quasi-totalité des réactions nucléaires peuvent avoir lieu spontanément, sans intervention extérieure. On les appelle alors des réactions nucléaires spontanées. Comme pour la radioactivité, les réactions spontanées ne sont pas prévisibles et ont lieu plus ou moins aléatoirement. Tout au plus, on peut supposer que des processus interne au noyau causent sa scission ou l'émission de nucléons.
Mais il est aussi possible d'induire des réactions nucléaires, en bombardant un noyau avec des nucléons. Le nucléon impacteur peut interagir avec le noyau et causer sa perte, mais il peut aussi simplement rebondir dessus. Les réactions de rebond sont appelées des réactions de diffusion nucléaire. Dans les autres cas, le nucléon impacteur peut faire fissionner le noyau ou fusionner avec lui : il peut être absorbé par le noyau, par exemple. Ces réactions de fission ou fusion suite à impact sont de véritables réactions nucléaires dignes de ce nom et sont appelées des réactions nucléaires induites, sous entendu : induites par l'impact/absorption du nucléon.
La fission nucléaire
[modifier | modifier le wikicode]
Il arrive que le noyau se scinde en plusieurs noyaux distincts : on parle alors de fission nucléaire. Ce processus n'arrive que pour des noyaux instables très lourds, qui profitent de la fission pour réduire leur énergie de liaison (et donc leur nombre de nucléons). Rappelons que l'énergie de liaison varie avec le nombre de nucléons, avec un minimum localisé au niveau du Fer-56. Pour les noyaux plus lourds que le Fer-56, l'énergie de liaison augmente avec le nombre de masse A. Les noyaux sont de plus en plus instables quand le nombre de nucléons augmente. Dans ces conditions, au lieu d'avoir un noyau avec beaucoup de nucléons, mieux vaut avoir deux noyaux avec moins de nucléons chacun. C'est ce qui est responsable du processus de fission nucléaire. À noter que la radioactivité alpha a la même raison : éliminer un excès de nucléons par rapport au Fer-56. La différence est que la fission se produit essentiellement pour des noyaux beaucoup plus lourds, qui ont beaucoup d'énergie à perdre. De simples désintégrations alpha ne permettraient pas de se rapprocher suffisamment rapidement du Fer-56, alors que la fission le peut.
De l’ambiguïté de la notion de fission
[modifier | modifier le wikicode]Petite remarque : on peut considérer l'émission d'un proton et la radioactivité alpha comme des formes particulières de fission. Une définition restreinte de la fission est que la fission doit donner naissance à deux noyaux approximativement similaires, aux nombres de masse semblables. La radioactivité alpha, où un noyau avec un A très élevé ne perd que 4 nucléons, ne rentre alors pas dans ce cadre, pas plus que l'émission d'un proton. Mais si on vise large, la fission représente tout cas où un noyau se scinde en deux autres noyaux. Cette définition plus large englobe parfaitement la radioactivité alpha et l'émission de proton : après tout, les particules alpha sont des noyaux d'Hélium-4 et les protons sont des noyaux d'hydrogène... Pour résumer, la fission au sens large regroupe :
- L'émission d'un proton, équivalente à une fission donnant un noyau d'hydrogène : .
- La radioactivité alpha, où le noyau se scinde en un noyau d'Hélium-4 et un autre noyau : .
- La radioactivité de clusters, où un noyau émet un "mini-noyau" assez petit : . Le mini-noyau est un regroupement de plusieurs nucléons, plus gros qu'une particule alpha, mais plus petit qu'un fragment de fission.
- La fission proprement dite, où les deux noyaux produits ont une taille similaire, assez grosse (les produits de la fission sont des noyaux lourds).
- On peut cependant noter que la radioactivité de clusters et la radioactivité alpha se basent sur un mécanisme physique similaire, différent de la fission normale. Avec les radioactivités alpha et de clusters, la particule émise était préformée dans le noyau initial. On trouvait déjà la particule dans le noyau initial, avant qu'elle ne soit éjectée. Les théories qui expliquent la radioactivité alpha (comme la théorie de Gamow survolée dans le chapitre sur la radioactivité) fonctionnent aussi très bien pour expliquer la radioactivité de clusters. Ce n'est pas le cas pour la fission ou l'éjection d'un nucléon. Par exemple, pour la fission, aucun des deux noyaux n'était préformé avant la fission.
La fission induite
[modifier | modifier le wikicode]
La fission induite est un cas de fission engendré par un projectile envoyé sur le noyau.

Selon la nature du projectile et le processus causant la fission, on distingue :
- La fission par photo-fission. Le projectile est un photon gamma de haute énergie qui est absorbé par le noyau. L'absorption fait passer le noyau impacté dans un état excité, où il est en surplus d'énergie. Le noyau peut éliminer ce surplus (se désexciter) en émettant un photon gamma, ou en fissionnant. Dans le dernier cas, on fait face à une fission induite par photo-fission.
- La fission par spallation. Ici, le projectile est une particule matérielle qui impacte le noyau tellement fort qu'il se brise en plusieurs éléments. Ce n'est donc pas tellement une fission mais plus un cassage de noyau avec des projectiles très énergétiques.
- La fission par capture d'un nucléon. Ici, le projectile est un neutron de faible énergie, qui est absorbé par le noyau. La différence avec la spallation est que l'impact n'est pas assez puissant pour casser le noyau. L'absorption du nucléon fait passer le noyau en état excité, ce qui le force à fissionner pour se désexciter. Un exemple classique, vu au chapitre précédent, est celui de la fission induite de l'Uranium-235. Quand un noyau d'U-235 absorbe un neutron, il devient un noyau d'U-236 instable qui fissionne en un noyau de Barium-141, un noyau de Krypton-92 et quelques neutrons. La fission en question est illustrée ci-contre.
La fusion nucléaire
[modifier | modifier le wikicode]Avec la fusion nucléaire, plusieurs noyaux fusionnent en un seul noyau. En voici deux exemples :
- Le premier schéma donne l'exemple de la fusion entre deux noyaux de Lithium-6 et de Deutérium (un isotope de l'hydrogène). Ceux-ci fusionnent pour donner un noyau de Béryllium-8, avec 4 protons et 4 neutrons, qui se désintègre immédiatement en deux noyaux d'Hélium-4 (deux protons et deux neutrons).
- Le second schéma donne l'exemple de la fusion entre deux noyaux de tritium et de deutérium (deux isotopes de l'hydrogène). Ceux-ci fusionnent pour donner un noyau d'hélium 5, avec deux protons et trois neutrons, qui se désintègre immédiatement en un noyau d'hélium 4 (deux protons et deux neutrons) et un neutron. On voit que, dans cet exemple tout du moins, une partie de l'énergie de masse des atomes qui ont fusionné est transformée en énergie cinétique, ces dernières étant exprimées en électron-volts.
 |
 |
- Formellement, les réactions de capture d'un nucléon peuvent être considérées comme des cas particuliers de fusion, où l'un des noyaux fusionnant est réduit à un nucléon unique. Mais l'auteur de ce cours a préféré séparer la capture d'un nucléon de la fusion, par souci de clarté, de la même manière qu'il a décidé de séparer l'émission d'un nucléon de la fission.
Énergétique de la réaction de fusion
[modifier | modifier le wikicode]
La fusion ne peut se produire que dans des conditions bien précises. Il faut notamment que la force nucléaire soit suffisante pour rapprocher les deux noyaux, ce qui n'est possible que si les noyaux sont près les uns des autres. Si les noyaux sont trop éloignés, la répulsion électrique des protons va l'emporter sur la force nucléaire et les noyaux ne pourront pas s'assembler. Pour rapprocher les noyaux, on peut les projeter les uns contre les autres à une vitesse suffisante. L'énergie cinétique des noyaux atteindra alors une valeur suffisante pour compenser la répulsion électrique. Cela arrive quand la température est très élevée. Ainsi, la fusion n'a lieu efficacement qu'à des températures très élevées.

Il faut noter que le noyau final est plus stable que les deux noyaux fusionnants. En clair : son énergie est inférieure à la somme des énergies des noyaux initiaux. La raison est que l'énergie de liaison du noyau final est plus importante que celle des noyaux initiaux, d'où une légère perte. Ce surplus d'énergie est dissipé sous forme d'énergie cinétique. Pour résumer, la fusion nucléaire dégage de l'énergie, sous forme de chaleur.
Exemple : la nucléosynthèse stellaire
[modifier | modifier le wikicode]
Un exemple classique de fusion nucléaire est celle qui se produit à l'intérieur des étoiles. Rappelons que les étoiles sont des boules de gaz à l’intérieur desquelles se produisent des réactions nucléaires. Ce sont ces dernières qui produisent de la chaleur et de la lumière : sans elles, les étoiles ne brilleraient pas. Les processus de fusion stellaire sont assez nombreux et regroupent plusieurs réactions de fusion distinctes. Toutes ont en commun d'avoir lieu à de fortes températures, qu'on ne peut trouver qu'au centre de l'étoile, dans une portion appelée le noyau stellaire. À cet endroit, la gravité est telle que la matière est compressée à des pressions inimaginables et s'échauffe sous l'effet de la pression. Les conditions de température et de pression sont optimales pour déclencher des réactions nucléaires. Tout autour du noyau, on trouve des couches de gaz moins chaudes, mais dans lesquelles il ne se produit pas de réactions nucléaires. On distingue deux couches, dans lesquelles les processus de transfert de chaleur vers la surface sont différents : par rayonnement pour la couche radiative et par convection pour la couche convective. Au-dessus, on trouve l'atmosphère de l'étoile.

Peu après le Big-Bang, les premiers noyaux à s'être formé étaient de l'Hydrogène et de l'Hélium : environ 75% d'H et 25% d'He, avec quelques traces des autres éléments. Les premières étoiles à s'être formées étaient intégralement composées d'Hydrogène et d'Hélium, les deux éléments chimiques les plus communs dans l'univers. Les autres éléments sont apparus dans les étoiles, grâce aux réactions nucléaires que l'on trouve en leur sein. Les étoiles peuvent être vues comme de formidables réacteurs nucléaires de fusion, qui créent les éléments lourds (au-delà de H et de He) lors de leur vie. Sans étoiles, nous n'aurions jamais eu de Carbone, d'Oxygène, de Silicium, etc.
Toute étoile venant de naître est majoritairement composée d'H et de He, avec quelques pourcents d'autres éléments. Elle commence par transformer son H en He. Puis, elle va fusionner son Hélium pour donner du Carbone, qui lui-même sera transformée en Oxygène, et ainsi de suite jusqu’au Fer. L'étoile décante sous l'effet de la gravité et se stratifie progressivement par sa densité, chaque élément chimique donnant une couche à l'intérieur de l'étoile. Une fois arrivé au Fer, celui-ci ne peut plus fusionner en noyaux stables. Les réactions nucléaires s’arrêtent alors et l'étoile meurt. La section qui va suivre va expliquer comment les étoiles fabriquent ces éléments, comment chaque élément est fabriqué l'un après l'autre au cours de la vie de l'étoile.
Dans les grandes lignes, on peut distinguer plusieurs réactions nucléaires principales dans les étoiles :
- la chaine proton-proton et le cycle CNO (Carbon Nitrogen Oxygen), qui transforme l'Hydrogène en Hélium ;
- le processus triple-alpha, qui transforme l'Hélium en Carbone;
- Les réactions alpha et les processus p et r, qui fabriquent des noyaux plus lourds que le Carbone (Oxygène, Azote, Silicium, ...).
Chacun a lieu dans une plage de température particulière : chaque processus ne se déclenche que si une température minimale est atteinte, sans quoi les noyaux ne peuvent fusionner. Ci-dessous, le schéma donne la température à laquelle a lieu chaque processus, ainsi que la vitesse à laquelle il génère de nouveaux noyaux.

La chaine proton-proton
[modifier | modifier le wikicode]La première réaction que nous allons voir est prédominante chez les jeunes étoiles, surtout celles de faible masse. Il s'agit de la chaîne proton-proton, qui combinent plusieurs noyaux d'Hydrogène pour former de l'Hélium-4. Plutôt que d'une réaction unique, la chaîne proton-proton est une chaîne de réactions qui s’enchaînent les unes à la suite des autres. La réaction commence avec un noyau d'hydrogène, sur lequel des réactions de fusion et d'ajout de protons vont agir l'une après l'autre, augmentant ainsi son nombre de masse jusqu’à obtenir de l'Hélium-4.
On distingue plusieurs réactions en chaîne proton-proton, qui sont au nombre de quatre. En tout, on distingue les chaînes proton-proton de type I, II, III et IV. Environ 83.30% de l'Hélium est créé par la chaîne de type I, 16.68% par celle de type II, et 0.02 % par celle de type III - la chaîne de type IV est tellement rare qu'elle est négligeable. Elles partagent toutes les deux premières étapes, qui sont identiques dans toutes les réactions en chaîne proton-proton. Lors de ces deux premières étapes, un noyau d'hydrogène subit deux réactions de capture protonique, qui donne naissance à de l'Hélium-3. Vous remarquerez que le résultat final, l'Hélium-3, contient un neutron, qui est naturellement produit par désintégration bêta. Les réactions suivantes sont des réactions de fusion, qui varient selon la chaîne considérée.
Précisons enfin que le Deutérium peut aussi être produit par une réaction nucléaire impliquant deux protons et un électron. La réaction fait intervenir une capture électronique, différente de la désintégration bêta de la chaîne proton-proton.
L'ensemble des réactions des différentes chaînes proton-proton et la réaction précédente peut se résumer grâce au graphique ci-dessous.

Le cycle CNO
[modifier | modifier le wikicode]Les chaînes proton-proton ne sont pas les seules réactions qui transforment l'Hydrogène en Hélium dans les étoiles. Il faut aussi citer une autre classe de réactions, regroupées sous le nom de cycles CNO (Carbon Nitrogen Oxygen). Ces dernières impliquent des atomes de Carbone, d’Oxygène et d'Azote, qui sont consommés dans la réaction, mais sont régénérés avant la fin du cycle. En clair, ils agissent comme catalyseurs de la réaction nucléaire. En ne tenant compte que du début et du résultat final de la réaction, le cycle CNO s'écrit comme suit :
Les électrons et positrons créés par la réaction s'annihilent pour donner des rayons gamma. La réaction se simplifie donc en :
Il existe en tout quatre cycles CNO différents, appelés cycle CNO I, II, III et IV, à l'instar des chaînes proton-proton.
Le processus triple-alpha
[modifier | modifier le wikicode]
Le processus triple-alpha est une réaction nucléaire qui transforme trois particules alpha (noyaux d'Hélium-4 en un atome de Carbone 12.
Elle a lieu en deux étapes.
- La première réaction fusionne deux noyaux d'Hélium-4 pour donner du Bérylium-8.
- La seconde fusionne le noyau de Béryllium de l'étape précédente avec une particule alpha, pour donner du Carbone-12.
La réaction libère environ 7.275 MeV d'énergie. Elle n'a lieu que si la température est suffisamment intense, typiquement vers une centaine de millions de degrés (< °c. Cela n'arrive qu'une fois que l'étoile a consommé la quasi-totalité de son Hydrogène en Hélium. La température chutant temporairement, suite au tarissement des réactions proton-proton, l'étoile se contracte alors. La hausse de pression qui en découle fait grimper la température du noyau stellaire, jusqu’à ce que les réactions de chaîne triple-alpha puissent démarrer. L'étoile transforme alors son Hélium en Carbone.
Les réactions alpha
[modifier | modifier le wikicode]Les réactions alpha fabriquent des éléments lourds, plus lourds que le Carbone-12, par addition de particules alpha. Il s'agit formellement d'une chaîne de réactions nucléaires, chacune fusionnant une particule alpha à l'atome formé dans la réaction précédente. La chaîne de réaction commence au Carbone-12, qui est l'équivalent de trois particules alpha. Vu que chaque réaction ajoute une particule alpha, tous les atomes de la chaîne sont formés d'un multiple de particules alpha, ce qui leur vaut le nom d'éléments alpha. Ils comprennent : l'Oxygène (O), le Néon (Ne), le Magnésium (Mg), le Silicium (Si), le Soufre (S), l'Argon (Ar), le Calcium (Ca), le Titane (Ti), le Chrome (Cr), le Fer (Fe) et le Nickel (Ni). La chaîne s’arrête au Nickel-56, qui est le plus stable des éléments de la chaîne.
Les fusions du Carbone, du Néon, de l'Oxygène et du Silicium
[modifier | modifier le wikicode]
Les étoiles à un âge avancé contiennent de grandes quantités de Carbone, qui peuvent fusionner en éléments plus lourds. Cela peut se faire par les réactions alpha, vues précédemment, mais aussi par un autre ensemble de réactions : les réactions de fusion du Carbone. La différence avec les réactions alpha est qu'elles n'impliquent pas de particule alpha, mais uniquement des noyaux de Carbone qui fusionnent entre eux. Deux noyaux de Carbone fusionnent entre eux et donnent un atome de Magnésium excité, qui peut se désintégrer de 5 manières différentes. Ces réactions sont les suivantes :
Le Néon subit lui aussi des réactions de fusion avec d'autres éléments. Il peut fusionner avec un noyau d'hélium ou capturer un neutron, sans compter qu'il peut être brisé suite à l'absorption d'un photon gamma (photo-fission). Les réactions de fusion du Néon sont les suivantes :

D'autres réactions sont des réactions de fusion de l'oxygène, qui font fusionner deux atomes d'Oxygène.
Enfin, nous devons terminer avec les réactions de fusion du Silicium. À la différence des réactions précédente, il s'agit ici d'une chaîne de réactions qui se suivent les unes les autres, et qui impliquent toutes la fusion du Silicium avec une particule alpha. Exactement comme les réactions alpha, mais qui commenceraient avec le Silicium.
La loi de désintégration radioactive
À l'heure actuelle, les désintégrations sont considérées comme des phénomènes totalement aléatoires. Peut-être arriverons-nous un jour à une compréhension plus fine de l'origine des désintégrations, mais il est pour le moment impossible de prédire quand un noyau va se désintégrer. Cependant, l'aléatoire des désintégrations reste soumis à quelques régularités, qu'on peut décrire par des lois mathématiques.
La loi de désintégration radioactive
[modifier | modifier le wikicode]Si on prend un paquet de N noyaux instables, on sait que leur quantité va diminuer avec le temps. Les noyaux se désintégreront progressivement, ne laissant que leurs collègues pas encore désintégrés. On peut rendre compte de cela avec une loi statistique assez connue. Pour cela, il faut prendre un nombre de noyaux, avec suffisamment grand pour limiter les variations d'origine statistiques. Dans ces conditions, chaque noyau a une probabilité de se désintégrer durant un temps . On trouve alors la formule suivante, par définition.
Cette formule se réécrit comme suit :
Cette équation nous dit que le terme , appelé l'activité, est le nombre de noyaux qui se désintègrent durant un temps (c’est-à-dire ). Les physiciens peuvent mesurer l'activité d'un échantillon avec des détecteurs spécialisés, qui mesurent les rayonnements émis par les atomes radioactifs (un rayonnement = une désintégration). Pour la plupart des matériaux radioactifs, le nombre de désintégrations par secondes est assez élevé, ce qui demande d'utiliser des unités spéciales. L'unité la plus simple à manier est le Becquerel, nommé en l'honneur du physicien qui a découvert la radioactivité : un becquerel est égal à une désintégration par seconde. Mais son usage donne des résultats assez importants, de l'ordre de plusieurs dizaines de milliers de Becquerels pour la radioactivité d'un corps humain. Pour éviter ce désagrément, on utilisait autrefois le Curie, une unité nommée en l'honneur de Marie et Pierre Curie. Un Curie correspond aux nombres de rayonnements produits par un gramme de Radium, soit environ 37 milliards de désintégrations par secondes. Pour mettre les deux unités en comparaison, un millionième de Curie (1 microcurie) vaut 37 000 becquerels (Bq).
Une décroissance exponentielle
[modifier | modifier le wikicode]
La formule précédente est une équation différentielle, que l'on peut résoudre. La résolution donne une formule, qui donne le nombre de noyaux non-désintégrés en fonction du temps. Cette formule est appelée loi de désintégration radioactive.
- , avec le nombre de noyaux à l'instant .
Elle peut se réécrire aussi comme suit. Cette formule montre que le nombre de noyaux instables décroît exponentiellement avec le temps.
La constante de temps radioactive
[modifier | modifier le wikicode]Les physiciens utilisent souvent l'inverse de la probabilité , à savoir : , appelée : constante de temps radioactive. La formule précédente se réécrit alors comme suit :
Pour comprendre ce qu'est physiquement cette constante de temps, il suffit de prendre . On a :
Cette équation dit qu'il s'agit du temps pour que , c'est à dire 36,78% de la quantité initiale. Dit autrement c'est le temps pour que le nombre de noyaux ait diminué de , soit environ 63,2 %.
La demi-vie
[modifier | modifier le wikicode]La demi-vie est le temps mis pour que la moitié des noyaux se désintègre, on la note . On peut la calculer avec l'équation précédente. On pose . En faisant le remplacement dans l'équation , on trouve :
On prend le logarithme de deux côtés pour éliminer l’exponentielle :
Les formules liées au logarithme permettent de simplifier le premier terme :
On divise ensuite par :
En utilisant la constante de temps, on obtient :
Les filiations radioactives
[modifier | modifier le wikicode]Il se peut que le noyau produit suite à une désintégration soit lui aussi instable. Il n'est pas rare qu'un noyau instable se désintègre en un noyau lui-même instable, qui lui-même se désintègre en noyau instable, etc. Le résultat est une chaîne de désintégration, aussi appelée filiation radioactive. En parcourant la chaîne de désintégration, le noyau perd de plus en plus de nucléons, jusqu’à tomber sur un noyau stable, où la chaîne de désintégration cesse.
Le cas à deux désintégrations successives
[modifier | modifier le wikicode]Pour commencer, nous allons étudier le cas où deux désintégrations successives peuvent avoir lieu, à savoir un atome A se transmute en un atome B, qui lui-même se change en atome C : A -> B -> C. L'atome A a pour constante de désintégration , de même que les atomes B et C ont respectivement et pour constante de désintégration.
Le nombre d’atomes de A à un instant t suit la loi de désintégration radioactive vue plus haut :
- , avec le nombre de noyaux de A à l'instant .
L'atome B est dans un cas un peu différent. Certes, il se désintègre en atomes C en respectant la loi de désintégration radioactive. Mais il faut aussi prendre en compte l'ajout de nouveaux atomes de B, qui naissent des désintégrations de A. On a donc l'équation suivante (le terme de droite comprend les pertes et les apports : ) :
Or, on sait que , avec le nombre de noyaux de A à l'instant . En injectant cette équation dans la précédente, on a :
La résolution de cette équation différentielle donne, après de laborieux calculs :

Graphiquement, cela donne le graphique ci-contre. On voit que augmente avant de diminuer. On peut calculer le temps où atteint sa valeur maximale à partir des équations précédentes. Pour cela, on a juste à trouver le temps t qui annule la dérivée de (la dérivée s'annule quand t est à la valeur maximale). Pour cela, calculons la dérivée de l'équation précédente, ce qui donne :
L'équation précédente ne s'annule que si :
La dérivée d'une différence est égale à la différence de dérivées :
On réorganise les termes :
On applique la formule :
On réorganise les termes :
On utilise la formule :
On prend le logarithme des deux côtés :
On isole t :
Il est intéressant d'étudier ce qui se passe quand les deux constantes de temps et sont très différentes. On peut alors se retrouver dans deux cas : soit on a , soit . Étudions ces deux cas l'un après l'autre.
Le cas particulier de l'équilibre séculaire
[modifier | modifier le wikicode]Partons de l'équation vue plus haut :
Supposons que .
Le terme se simplifie alors comme suit :
- .
De plus, le terme se simplifie aussi, ne laissant que la deuxième exponentielle :
En combinant toutes les équations précédentes, on trouve
Ce qui peut être interprété comme une simple désintégration radioactive d'une seule étape, celle du noyau B. En clair, la désintégration du noyau A est tellement rapide que tous les noyau A deviennent presque instantanément les noyaux B. Le nombre de noyaux B avant sa propre désintégration n'est autre que le nombre de noyaux A initial .
Le cas particulier de l'équilibre
[modifier | modifier le wikicode]Comme précédemment, partons de l'équation vue plus haut :
Supposons que . Le terme se simplifie, ne laissant que la première exponentielle :
En combinant toutes les équations précédentes, on trouve
Ce qui est logique, car le noyau B doit attendre que le noyau A se désintègre pour être produit.
En termes d'activité, comme le noyau B se désintègre immédiatement après avoir été produit, son activité augmente fortement pendant un laps de temps très court mais atteint rapidement un plateau car comme dit précédemment, le noyau B doit attendre que le noyau A se désintègre pour se désintégrer à son tour. En conséquence, l'activité du noyau B tend vers une valeur équilibre, l'activité du noyau A. Comme tout à l'heure, la chaîne de désintégration se résume donc à une seule désintégration, celle du noyau A.
Le cas général (les équations de Bateman)
[modifier | modifier le wikicode]Dans la réalité, les filiations radioactives ont bien plus de 2 réactions successives. Le cas général, avec plus de deux désintégrations successives, est plus complexe à étudier. Dans ce qui va suivre, nous allons prendre une chaîne de N désintégrations : . Chaque désintégration est similaire à l'équation du noyau B de la section précédente : la quantité du noyau diminue du fait des désintégrations, mais il reçoit des apports des désintégrations du noyau . Si on note le nombre de noyaux de l'espèce , on a :
On pourrait développer chaque terme, en calculant chaque et en l'injectant dans chaque , comme nous l'avons fait dans le cas à deux désintégrations. Mais au-delà de 3 à 4 désintégrations successives, les calculs deviennent trop laborieux pour que cela soit faisable. Heureusement, il existe une formule qui permet de trouver une formule explicite générale pour , formule découverte par Henri Bateman. Celle-ci, très compliquée, est mentionnée juste par souci de complétude.
- Pour les curieux, voici un document qui démontre la formule de Bateman : chaîne de désintégration et équation de bateman.
Les branchements radioactifs
[modifier | modifier le wikicode]Certains noyaux peuvent se désintégrer de plusieurs manières, chacune donnant un noyau différent. Chaque possibilité de désintégration est appelée une voie de désintégration et a sa propre probabilité de désintégration. Le cas le plus simple est celui où un noyau a deux voies de désintégration, chacune avec sa probabilité. Un bon exemple est celui du Potassium-40, qui peut se désintégrer en Calcium-40 ou en Argon-40. La probabilité pour que le Potassium-40 se désintègre en Calcium-40 est d'environ 89,28%, l'autre voie de désintégration n'ayant qu'une faible probabilité de 10,72%
 |
 |
Dans ce cas, on peut reformuler la loi de désintégration radioactive comme suit :
On voit que la probabilité de désintégration totale est la somme de la probabilité de désintégration de chaque voie. Ce résultat se généralise avec plus de deux voies de désintégration.
La constante de temps associée est de :
L'interaction nucléaire
Il n'est pas rare de trouver des nucléons isolés, en dehors de tout noyau, mais ce n'est pas la norme. La plupart se trouvent dans des noyaux atomiques et il faut fournir de l'énergie pour les en séparer. De plus, les nucléons ont naturellement tendance à s'assembler en noyaux atomiques s'ils sont très proches. Ce phénomène est assez similaire, dans les grandes lignes, à la formation d'un atome à partir de noyaux et d'électrons. Dans le cas de l'atome, c'est la force électromagnétique qui fait qu'électrons et noyaux s'attirent au point de s'assembler en atomes. Pour la formation d'un noyau à partir de nucléons, c'est presque la même chose : les nucléons s'attirent au point de s'assembler en noyaux.
Sauf que pour la formation des noyaux, l'interaction électromagnétique n'est pas en cause : les neutrons ne sont pas influencés par cette interaction, sans compter que les protons se repoussent vu qu'ils sont de même charge électrique. La gravité n'est pas non plus en cause : le calcul nous dit que les masses des nucléons sont trop faibles. On est bien obligé d'admettre qu'il existe une autre force qui attire les nucléons entre eux, la force nucléaire. Celle-ci agit sur les nucléons et quelques particules semblables nommées hadrons.
La force nucléaire
[modifier | modifier le wikicode]De nombreuses expériences ont donné des indications précieuses pour comprendre la force nucléaire. La plupart de ces expériences sont des expériences de collision entre nucléons : on fait entrer deux nucléons en collision et on regarde ce qui se passe. Avec un peu de chance et des conditions optimales, la collision donne naissance à un noyau composé de deux nucléons. On peut aussi faire entrer en collision un noyau avec un nucléon et le faire grossir petit à petit, ce qui donne des indications sur la force nucléaire. Enfin, des expériences d’interférométrie de nucléons ont aussi été utilisées dans ce but. Mais concentrons-nous pour le moment sur ce que ces expériences nous ont appris sur la force nucléaire.
Les propriétés statiques de la force nucléaire
[modifier | modifier le wikicode]L'expérience montre que la force nucléaire peut être aussi bien attractive que répulsive : tout dépend de la distance entre les deux nucléons. Quand les deux nucléons sont extrêmement proches, la force nucléaire est fortement répulsive. Mais si les deux particules sont "loin", la force nucléaire est attractive. Ce comportement est assez inédit, mais a des implications assez importantes. En premier lieu, le caractère attractif à longue distance permet aux nucléons de se condenser en noyaux : les nucléons éloignés s'attirent et ont donc tendance à se regrouper en noyaux. Une conséquence du caractère répulsif à courte distance est que le noyau atomique est presque incompressible : rapprocher deux nucléons demande une force énorme pour surcompenser la force nucléaire.
Expérimentalement, la force nucléaire se moque de la nature des nucléons : à distance égale, cette force sera identique entre deux neutrons, deux protons, ou entre un proton et un neutron. Cette propriété est appelée l'indépendance à la charge de la force nucléaire.
Une des difficultés pour mettre en question la force forte est sa dépendance au spin. Pour le dire simplement, la force forte entre deux nucléons n'est pas la même selon que leurs spins sont alignés ou non. La force forte est bien plus forte quand deux nucléons ont leurs spins alignés dans le même sens, que quand leurs spins sont opposés.
La relation force-distance
[modifier | modifier le wikicode]
Comme vous le savez peut-être, la plupart des forces est assez bien approximé par une force centrale, à savoir une force convergeant/divergeant d'un point central. La force nucléaire est aussi une force centrale, en première approximation. En clair, un nucléon est la source d'une force qui converge vers lui et/ou diverge de lui. Pour une force centrale, l'intensité de la force dépend uniquement de la distance. Pour la gravité et l'électricité, la force est proportionnelle au carré de la distance, par exemple. Mais pour la force nucléaire, la relation distance-force n'est pas linéaire, ni même proportionnelle au carré de la distance. La relation est beaucoup plus compliquée, mais elle est globalement bien illustrée ci-contre.
Déjà, comme dit plus haut, la force nucléaire est répulsive à courte distance, mais attractive sur les longues distances. Ensuite, sur les longues distances, la force nucléaire diminue exponentiellement avec la distance. En conséquence, la force nucléaire diminue plus vite que la force électromagnétique sur les longues distances. À partir d'une certaine distance, la répulsion entre protons sera plus forte que la force nucléaire. Les physiciens en déduisent que les noyaux avec un grand nombre de protons peuvent plus facilement se briser ou perdre des nucléons. Certains pensent même qu'il existe une limite maximale au nombre de protons dans un noyau ou au rapport entre protons et neutrons.
Précisons que la force nucléaire n'est pas exactement une force centrale : si elle est bien approximée par une force centrale, des déviations apparaissent à haute énergie et des termes non-centraux doivent être ajoutés aux équations. C'est aussi le cas de la gravité et de l'électricité : autant la loi de la gravitation de Newton est une bonne approximation, autant la relativité générale va plus loin que la simple loi en 1/r². Dans le cas de la force nucléaire, on peut la décomposer en trois termes distincts :
- une force centrale, répulsive à courte distance et attractive à longue distance ;
- une force tensorielle, qui dépend de l'orientation des spins des nucléons ;
- une force spin-orbite, qui dépend du mouvement des spins l'un par rapport à l'autre.
Le potentiel nucléaire
[modifier | modifier le wikicode]La force nucléaire a des points communs assez forts avec la gravité, le magnétisme et l'électricité. Notamment, ces forces proviennent chacune d'une source : objet massif pour la gravité, charge électrique pour l'électricité, aimant pour le magnétisme, et nucléon pour la force nucléaire. De plus, ces forces fournissent une énergie potentielle aux objets sur lesquels elles agissent. Vous avez peut-être déjà entendu parler de l'énergie potentielle de gravitation/de pesanteur, ou encore de l'énergie potentielle électrostatique. Eh bien la même chose existe pour l'énergie nucléaire. Chaque nucléon influence les nucléons environnants en leur fournissant une énergie potentielle nucléaire, qui dépend de la distance avec la source (mais pas que). La force nucléaire vient du fait que les nucléons tentent de minimiser leur énergie potentielle et se déplacent vers l'endroit où elle est la plus faible, c’est-à-dire proche du nucléon à l'origine du potentiel. La forme du potentiel, à savoir sa relation avec la distance du nucléon, est illustrée avec le graphique suivant, qui montre la valeur du potentiel entre deux nucléons, exprimée en fonction de la distance qui les sépare.

L'énergie potentielle totale est impossible à calculer à l'heure actuelle (début 2016), même si diverses théories en donnent une approximation convenable. On sait que la force nucléaire est une sorte de résidu de la force qui s'exerce entre les quarks et les gluons. Les quarks d'un même nucléon s'attirent entre eux, mais les spécificités de la force forte font que cette attraction déborde quelque peu des nucléons. Le résultat est qu'il apparaît une force nucléaire entre nucléons. Une théorie complète de la force nucléaire doit donc être dérivée de la chromodynamique quantique, la théorie qui décrit l'interaction forte, les quarks et les gluons. Mais certaines théories se passent de ce genre de fioritures et donnent des développements plus simples à comprendre.
Les modèles descriptifs du potentiel nucléaire central
[modifier | modifier le wikicode]Comme dit plus haut, la force nucléaire est la somme de plusieurs forces, donc de plusieurs potentiels différents. Le potentiel nucléaire est la somme d'un potentiel central, d'un potentiel tensoriel et d'un potentiel spin-orbite. Le potentiel s'écrit donc :
Une bonne approximation du potentiel nucléaire est de dire qu'il est constant dans tout le noyau, sauf en périphérie où il diminue très rapidement avec la distance. La formule de Saxon-Woods donne une bonne approximation du potentiel nucléaire, avec :
- le potentiel central et est le potentiel central au centre du noyau ;
- est la distance par rapport au centre du noyau ;
- est le rayon du noyau, dans la partie où le potentiel est constant ;
- est la longueur sur laquelle le potentiel chute rapidement en périphérie.
Une autre approximation est donnée par le potentiel de Reid, à savoir la formule suivante :
Le couplage spin-orbite
[modifier | modifier le wikicode]Les deux formules précédentes décrivent correctement le potentiel central, mais laissent de côté les deux autres composantes. Mais les potentiels centraux ne permettent pas de décrire correctement l'interaction nucléaire, même en première approximation. Il faut leur ajouter une composante tensorielle, ainsi qu'un couplage spin-orbite. Si l'on peut négliger la composante tensorielle, en première approximation, ce n'est pas le cas de la composante spin-orbite. L'interaction nucléaire dépend si fortement des spins des nucléons que l'on doit la prendre en compte dans un modèle complet. La composante spin-orbite est approximativement égale à :
- , avec le moment cinétique orbital d'un nucléon et le spin du nucléon. Le terme est une fonction des coordonnées dans le noyau.
On peut calculer facilement le terme en partant de la définition du moment cinétique total. Pour rappel, celui-ci est la somme du spin et du moment cinétique orbital :
Élevons le tout au carré :
On réorganise les termes :
Rappelons que du fait de la quantification de l'énergie, on a , et , ce qui donne :
On sait que , on a . En injectant dans l'équation précédente, on a :
- , pour
- , pour
On voit que le potentiel spin-orbite dépend donc de la valeur du spin, et qu'il peut prendre deux valeurs différentes selon le spin. La différence d'énergie entre l'état de spin et l'état se calcule en soustrayant les deux équations précédentes et en multipliant par le potentiel de base. Cela donne :
La théorie de Yukawa
[modifier | modifier le wikicode]
Historiquement, le premier modèle du potentiel nucléaire crée par un nucléon a été inventé par Yukawa en 1935. Selon sa théorie, le nucléon source émet des particules qui servent d'intermédiaires pour la force nucléaire. Quand un nucléon environnant absorbe ces particules intermédiaires, il est attiré ou repoussé du nucléon source. La particule intermédiaire possède de plus une masse, ce qui fait que la force induite a une portée assez limitée. En élaborant cette idée dans le cadre de la physique quantique, Yukawa trouva la formule suivante pour le potentiel, où g est une constante, m est la masse de la particule intermédiaire et r est la distance entre les deux nucléons.
Dans le cas particulier où , on retrouve le potentiel en d'interaction électrostatique (la loi de Coulomb) et du potentiel gravitationnel. Pour la force nucléaire forte et faible, le coefficient est plus important, ce qui fait que le potentiel nucléaire ne suit pas une loi en , mais chute plus vite, d'où le fait que la force nucléaire est une force à courte-distance. Ci-dessous, on montre le potentiel en fonction de la distance r, pour diverses valeurs de m. On voit que plus m est grand, plus le potentiel de Yukawa se concentre sur de courtes distances.
 |
 |
Après la publication de la théorie de Yukawa, les physiciens se mirent en quête de la particule intermédiaire. Les premiers soupçons se portèrent sur des particules comme le méson pion, le méson rho, le méson sigma, le méson oméga, etc. Mais les propriétés de ces particules donnaient une force nucléaire soit totalement attractive, soit totalement répulsive : aucune ne donnait une force nucléaire attractive à longue distance et répulsive à faible distance. De nos jours, on pense qu'il existerait plusieurs types de particules intermédiaires. La répulsion à courte distance provient des mésons rho et sigma, l'attraction à courte distance provient des mésons oméga, et l'attraction à longue distance provient des mésons phi (les pions).
La constante de couplage de la QCD
[modifier | modifier le wikicode]La formule de Yukawa peut se scinder en deux parties : un terme qui détermine la puissance de la force, et un second terme qui décrit comment elle évolue avec la distance. Le premier terme est proportionnel à ce qu'on appelle la constante de couplage de l'interaction nucléaire forte, un paramètre qui détermine la puissance de cette force, l'amplitude de ses effets sur la matière. Plus elle est forte, plus l'interaction est importante. La constante de couplage vaut, par définition :
La théorie quantique nous dit que si la constante de couplage est assez faible, proche de 1, l'interaction est alors assez faible. Sous cette condition, elle peut être approximée par des techniques dites perturbatives. En utilisant ces techniques, on peut formuler la plupart des équations en utilisant les puissances de g, ce qui rend le traitement mathématique assez simple et les approximations faciles. Mais dans le cas de la force forte, la constante de couplage est bien plus grande que 1 et ces techniques ne sont pas applicables. À vrai dire, c'est pour cela qu'on l'appelle la force forte : sa constante de couplage est très importante.
La constante de couplage dépend de l'énergie des nucléons interagissant
[modifier | modifier le wikicode]La constante de couplage porte mal son nom. La réalité est que si elle décrit bien un couplage entre deux particules, elle n'est pas constante. Elle varie en fonction de l'énergie des particules interagissantes. Le graphique ci-dessous illustre l'évolution de la constante de couplage en fonction de l'énergie. On voit qu'elle diminue avec l'énergie.
 |
 |
Vous remarquerez que la constante de couplage diminue de manière logarithmique avec l'énergie. Cela signifie que plus on fournit d'énergie à des nucléons, moins l'interaction forte entre eux sera forte. An fournissant suffisamment d'énergie à deux nucléons, on peut en théorie les séparer. À longue distance, deux nucléons ne vont presque pas interagir. Par contre, à courte distance, la force forte sera importante et elle suffira à condenser les nucléons en noyaux. L'évolution logarithmique de la constante de couplage a des conséquences assez intéressantes, mais très techniques à expliquer.
Le modèle de la goutte liquide
Le modèle de la goutte liquide fournit une approximation correcte de l'énergie de liaison et permet de rendre compte de la vallée de stabilité avec une bonne précision. Cette théorie montre rapidement ses limites : elle ne permet pas d'expliquer l'existence de nombres magiques, ni pourquoi les noyaux avec un nombre Z ou N pair sont plus stables que les autres. Néanmoins, elle permet de rendre compte de la forme de la vallée de stabilité assez facilement. Son point faible est de ne pas prendre en compte l'organisation des nucléons dans le noyau, chose que les modèles suivants font.
Il se base sur une analogie entre un noyau atomique et une goutte de liquide, d'où son nom. En effet, un noyau est un ensemble de nucléons liés entre eux par une force attractive à longue distance, qui se repoussent à courte distance. Une goutte d'eau est assez similaire, dans le sens où elle est aussi composée de particules (des molécules d'eau) qui s'attirent à longue distance et se repoussent à courte distance (à cause d'effets électromagnétiques). Les hypothèses du modèle de la goutte liquide sont donc les suivantes : le noyau contient beaucoup de nucléons, ces nucléons sont sphériques et le noyau a une forme sphérique (dans le cas le plus simple). Le modèle de la goutte liquide dit que l'énergie de liaison du noyau est la somme de plusieurs énergies distinctes : une énergie de volume, une énergie de surface (tension superficielle), une énergie de répulsion électrostatique coulombienne, une énergie d’asymétrie et une énergie d’appariement.

Le modèle de base
[modifier | modifier le wikicode]Dans sa version la plus simple, le modèle dit que l'énergie de liaison est la somme de plusieurs termes :
- une énergie liée à la force nucléaire ;
- une énergie liée à la répulsion des protons ;
- et d'autres termes d'origine quantique.
L'énergie de volume
[modifier | modifier le wikicode]L'énergie de volume rend compte du fait que chaque nucléon d'un noyau est entouré par d'autres nucléons. Chaque nucléon va donner une certaine énergie potentielle nucléaire aux autres nucléons du noyau. L'énergie potentielle nucléaire du noyau est donc la somme de l'énergie potentielle nucléaire de chaque nucléon. Pour rappel, la force nucléaire a une portée limitée : chaque nucléon interagit avec ses voisins immédiats, mais pas avec les autres nucléons du noyau. Ainsi, chaque nucléon n'interagit qu'avec un nombre constant de nucléons voisins. Dit autrement, l'énergie potentielle est égale au nombre de nucléon, multiplié par une constante qui rend compte du nombre de voisins et de la force nucléaire entre deux nucléons.
- , avec l'énergie de volume et la constante qui rend compte du nombre de voisins et de la force nucléaire entre deux nucléons.
L'énergie de surface
[modifier | modifier le wikicode]Mais ce raisonnement ne veut que pour les nucléons situés dans le noyau. Les nucléons situés à la surface ont un nombre de voisins qui est inférieur : ils ne sont pas totalement entourés. En conséquence, on doit corriger l'énergie de volume pour en tenir compte. On doit donc retrancher une énergie de surface à l'énergie de volume, cette énergie de surface dépendant du nombre de nucléons situés à la surface du noyau. Cette énergie est donc proportionnelle à la surface du noyau, qui est elle-même proportionnelle à (résultat tiré du chapitre sur la description des noyaux atomiques). D'après ce raisonnement, on obtient l'équation suivante :
- , avec l'énergie de surface, une constante et le rayon du noyau.
L'énergie de répulsion électrostatique
[modifier | modifier le wikicode]Enfin, il faut aussi tenir compte du fait que les protons d'un noyau se repoussent à cause de leur charge électrique. Cette répulsion est causée par une énergie potentielle électrostatique, qui s'ajoute à l'énergie du noyau. En clair, cette répulsion diminue l'énergie de liaison en ajoutant un terme d'énergie coulombienne. Sans rentrer dans les détails, on peut considérer que le noyau est une sphère dont la densité de charge (la charge électrique par unité de volume) est constante. Sous une telle hypothèse, les lois de l’électrostatique nous disent que l'énergie potentielle électrostatique est donnée par la formule qui suit, où est l'énergie coulombienne, est la charge totale de la sphère et est le rayon de la sphère.
Pour le noyau, on a : et (avec le rayon d'un nucléon, qui est une constante). En injectant dans la formule précédente, on trouve :
Regroupons tous les termes constants dans un même terme, séparé du terme avec Z et A (les deux seules variables).
Collapsons le terme purement constant en une seule constante .
L'énergie de liaison totale
[modifier | modifier le wikicode]L'énergie de liaison totale du noyau est simplement la somme des termes vus plus haut. Précisons que l'énergie de volume est comptée positivement, alors que les autres formes d'énergie sont comptée négativement. La raison est que l'énergie de volume causée par une force attractive, alors que les autres termes sont liés à des forces répulsives (force de répulsion électrostatique pour le terme d'énergie électrostatique, déficit local en énergie de volume pour l'énergie de surface). On a donc :
Le modèle de la goutte liquide se résume donc en une seule équation, que voici :
Diverses études statistiques ont tenté de trouver des valeurs pour les coefficients , et qui rendent compte efficacement de la masse des noyaux. Les résultats sont très disparates. Pour donner un exemple, certaines études donnent un égal à 16 quand d'autres donne un résultat de 14, et la différence est encore plus marquée pour les autres termes. Et les coefficients trouvés ne fonctionnent bien que pour des noyaux avec un A très grand. Pour les noyaux légers, avec un A faible, cette formule ne marche pas (ce qui est cohérent avec les hypothèses du modèle).
Les extensions du modèle
[modifier | modifier le wikicode]Le modèle de la goutte liquide vu précédemment ne donne pas de très bons résultats. Il a notamment tendance à surestimer l'énergie de liaison des noyaux. Et ce n'est pas si étonnant, car les termes d'énergie de volume, de surface et de répulsion électrostatique sont tirés d'une analogie avec une goutte d'eau liquide, un système parfaitement décrit par la physique classique. Le modèle précédent ne fait pas usage de la mécanique quantique. Pour rendre le modèle plus fiable et plus précis, il faut tenir compte de la nature quantique des nucléons, ce qui demande de corriger le modèle précédent, en ajoutant des termes ou des corrections de nature quantique. La solution la plus simple, pour ce faire, consiste à ajouter deux termes d'origine quantique : l'énergie d'asymétrie et l'énergie d'appariement. Mais on peut aller plus loin, ce que font de nombreux physiques, comme le modèle collectif, par exemple. Mais nous allons nous concentrer sur l'extension la plus simple, qui rajoute les deux termes d’appariement et d'asymétrie.
L'énergie d'asymétrie
[modifier | modifier le wikicode]
L'énergie d'asymétrie, rend compte du fait que les noyaux sont plus stables quand le nombre de neutrons et de protons est identique (si on néglige l'effet de la répulsion électrostatique). Tout excès de neutrons ou de protons entraîne une hausse de l'énergie du noyau. Néanmoins, cet effet dépend du nombre de nucléons dans le noyau : un excès de deux protons n'a pas le même effet dans un noyau composé de 50 nucléons que dans un noyau composé de 2 nucléons. Rendre compte de ce phénomène demande juste d'ajouter un terme qui est proportionnel à la différence entre nombre de protons et de neutrons, et inversement proportionnel au nombre de nucléons. Ainsi, l'énergie d'asymétrie vaut :
L'énergie d'appariement
[modifier | modifier le wikicode]
L'énergie d'appariement tente de rendre compte du fait que les noyaux avec un nombre pair de neutrons ou de protons sont plus stables que les autres. Empiriquement, il semblerait que cette énergie a une valeur absolue proportionnelle à la racine carrée de A. Pour les noyaux avec Z et N pair, cette énergie est comptée en positif, additionnée à l'énergie de liaison. Pour les noyaux avec Z et N impair, cette énergie est comptée en négatif, soustraite à l'énergie de liaison. Pour les noyaux avec Z et N de parité différente, cette énergie est nulle.
Les prédictions du modèle de la goutte liquide
[modifier | modifier le wikicode]En ajoutant les deux termes d'asymétrie et d’appariement au modèle de base, on trouve l'équation suivante, connue sous le nom de formule de Bethe-Weizsäcker :
L'équation de la vallée de stabilité
[modifier | modifier le wikicode]La formule de Bethe-Weizsäcker permet de rendre compte de la vallée de stabilité des noyaux. En effet, l'énergie de répulsion électrostatique augmente en Z², alors que les autres termes varient linéairement en fonction de A. Ce qui veut dire qu'au-delà d'un certain Z/A, l'énergie de répulsion électrostatique doit surpasser l'énergie de liaison liée aux forces nucléaires. On peut calculer le rapport Z/N idéal à partir de l'équation précédente : il suffit de dériver l'équation par rapport à Z. On trouve alors l'équation ci-dessous. Le résultat obtenu rend assez bien compte de la ligne de stabilité, mais ce n'est pas parfait.
La parabole de masse
[modifier | modifier le wikicode]On peut reformuler la formule de Bethe-Weizsäcker pour un A (nombre de masse) fixé.
Cette équation est un polynôme du second degré de la forme :
- , avec , et .
Cette équation est celle de plusieurs paraboles, appelées paraboles de masse. Pour comprendre pourquoi cette équation correspond à plusieurs paraboles, il faut remarquer que l'énergie d'appariement peut prendre plusieurs valeurs différentes : soit elle est nulle, soit elle est positive, soit elle est négative. Pour simplifier, nous allons partir du principe que le nombre de masse est fixé une fois pour toute. En clair, les seules désintégrations possibles sont les désintégrations bêta, qui convertissent les noyaux en un de leur isobare. Avec un A fixé, on peut distinguer deux cas selon la valeur de l'énergie d'appariement : soit elle est nulle et A est impair, soit elle est non-nulle et A est pair. Ces deux cas permettent de comprendre un peu mieux les désintégrations bêta et permettent notamment de prédire quels noyaux subissent des désintégrations bêta+ et quels sont ceux qui subissent des désintégrations bêta-.
- Pour une énergie d'appariement nulle, A est impair. Dans ce cas, l'équation est celle d'une parabole unique : il n'y a qu'une seule parabole. L'état le plus stable est obtenu pour une énergie minimale, ce qui fait que l'isobare stable est celui situé au creux de la parabole. Les noyaux situés sur la branche de droite tendent à perdre des protons pour atteindre le fond de la parabole, via désintégration bêta plus. En l'inverse, ceux sur la branche de gauche gagnent des protons par désintégration bêta moins.
- Pour une énergie d'appariement non-nulle, le nombre de masse A est pair. On peut alors se retrouver dans un des deux cas suivant : et N et Z sont pairs, ou alors et N et Z est sont impairs. Chaque cas donne une parabole différente de l'autre, ce qui fait deux paraboles différentes au total. Ces deux paraboles sont illustrées ci-contre. La parabole du dessus est toujours celle des noyaux impair-impair, alors que celle du dessous est toujours celle des noyaux pair-pair. Le creux de leur parabole est plus bas, ce qui fait que les noyaux pair-pair sont plus stables que les noyaux impair-impair. Chose connue depuis quelques chapitres, mais pas expliqué alors.
 |
 |
La fission nucléaire des noyaux excités
[modifier | modifier le wikicode]Les développements vus plus haut supposent plus ou moins que le noyau a une forme sphérique, bien que de manière implicite. En fait, ils sont aussi valables pour des noyaux non-sphériques, mais les coefficients ne sont pas les mêmes. Les calculs précédents ne donnent pas une valeur exacte pour l'énergie de volume et l'énergie de surface. La raison à cela est qu'elles dépendent de la forme du noyau. Pour un noyau sphérique, le rapport surface/volume est minimal. En conséquence, l'énergie de volume est maximale, alors que l'énergie de surface est minimale. Mais si on déforme le noyau, l'équilibre sera différent : l'énergie de volume restera stable, alors que l'énergie de surface augmentera, au même titre que l'énergie de Coulomb (les protons s'éloignent un peu plus). Le noyau sera alors moins stable, ce qui favorisera sa désintégration. La radioactivité alpha et la fission sont alors facilitées et ont plus de chances de survenir.

Supposons que le noyau a une forme ovale, une forme d’ellipsoïde. Une ellipsoïde est représentée ci-contre, et on voit qu'elle a un grand axe a et un petit axe b. Nous allons comparer ce noyau avec un noyau sphérique de rayon R. Pour cela, nous allons prendre a et b tels que le volume de l’ellipsoïde et de la sphère sont identiques. Pour cela, on peut prendre a et b tels que :
Dans ce cas, le volume des deux noyaux est égal à :
Avec cette paramétrisation, l'énergie de surface et de Coulomb pour l'ellipsoïde sont égales à :
La différence d'énergie entre noyau sphérique et ellipsoïdal est donc égale à :
Si la différence d'énergie est positive, la fission est alors énergétiquement favorable et elle peut survenir (bien qu'elle puisse mettre du temps avant de survenir, voire qu'elle ne survienne jamais). Si on dérive l'équation précédente par rapport à A, on trouve la valeur pour laquelle le Delta d'énergie s'annule. Au-delà de cette valeur, le delta d'énergie est positif et la fission est possible. Par contre, en-deça de cette valeur, le delta d'énergie est négatif et la fission a peu de chances de survenir. Les calculs nous disent que cette valeur a lieu pour :
Cette condition est respectée pour A > 270 et/ou Z > 116. En clair, les noyaux avec un A de plus de 270 peuvent fissionner, mais les noyaux plus légers en sont incapables. Pareil pour les noyaux avec un A inférieur, mais avec Z > 116.
Le modèle du gaz de Fermi
Une manière simple de modéliser l'organisation en couches du noyau est d'utiliser le modèle du gaz de Fermi. Un gaz de Fermi est un ensemble de plusieurs fermions (pour rappel, les fermions sont des particules de spin égal à ). Le modèle suppose que les fermions en question n’interagissent pas, ce qui est formellement faux mais est une approximation suffisante pour ce qui suit. L'hypothèse de non-interaction entre fermions fait que le groupe de fermions se comporte comme un gaz parfait, ce qui permet de faire quelques dérivations assez simples. De plus, on suppose que le potentiel dans le volume occupé par le gaz est constant, ici le potentiel nucléaire dans le noyau. Un gaz de Fermi est donc, pour résumer, un ensemble de plusieurs fermions qui n'interagissent pas ensemble et qui sont placés dans un potentiel constant.
L'énergie et l'impulsion de Fermi
[modifier | modifier le wikicode]
Le modèle de Fermi donne diverses formules mathématiques utiles, la plus importante décrivant l'énergie d'un nucléon en fonction de l'état qu'il occupe. Vous savez que les particules dans le noyau atomique ne peuvent pas avoir une énergie arbitraire. Leur énergie évolue par paliers, par niveaux d'énergie quantifiés. Le tout est illustré ci-contre. Le niveau le plus bas est appelé le niveau fondamental et l'énergie qui correspond est appelée l'énergie fondamentale.
Les niveaux en question sont différents pour les protons et les neutrons. Le formalisme mathématique nous dit que le noyau se comporte comme le mélange de deux gaz : un gaz de protons et un gaz de neutrons. La physique quantique nous dit que, dans chaque gaz de protons/neutrons, chaque niveau d'énergie ne peut contenir que deux particules. Cela est lié au principe d'exclusion de Pauli, que nous aborderons dans le chapitre suivant. Au zéro absolu, les deux premiers protons occupent le premier palier, les suivants occupent le second palier, et ainsi de suite. Le niveau le plus élevé qui contient des particules est appelé le niveau de Fermi. En-dessous du niveau de Fermi, tous les niveaux sont remplis avec deux particules. Au-dessus, les niveaux sont inoccupés et vides de toute particule. Insistons sur le fait que nous parlons d'un ensemble de particules non-interagissantes et au zéro absolu. Au-dessus du zéro absolu, des particules remontent dans des niveaux au-dessus du niveau de Fermi, laissant des vides dans les niveaux en dessous.
L'énergie de Fermi
[modifier | modifier le wikicode]Le modèle du gaz de Fermi donne la différence entre l'énergie fondamentale et l'énergie du niveau de Fermi, pour un noyau de N particules. Cette différence est appelée, par abus de langage, l'énergie de Fermi. Les calculs nous donnent une approximation de l'énergie de Fermi du énième nucléon, qui vaut :
- , avec V le volume du noyau.
Précisons que l'énergie de Fermi est celle du énième nucléon, à une constante près. L'énergie du énième nucléon est alors égale à :
- .
À partir de cette formule, on peut calculer l'énergie totale du noyau. Cette dernière est égale à la somme de l'énergie de chaque nucléon, ce qui donne :
- , avec A le nombre de masse.
En combinant les deux équations précédentes, on a :
- , avec A le nombre de masse.
Quelques manipulations algébriques donnent :
On peut l'utiliser pour calculer l'énergie moyenne des nucléons dans un noyau de N particules. Le calcul donne :
l'impulsion de Fermi
[modifier | modifier le wikicode]L'énergie de Fermi est par définition une énergie cinétique : l'énergie cinétique que possède le énième nucléon dans un gaz de Fermi. Par défaut, le premier palier correspond à une particule sans impulsion, qui n'a que de l'énergie potentielle. Mais les niveaux au-dessus ne sont pas dans ce cas. En effet, le potentiel est le même dans tout le gaz, ce qui fait que l'énergie potentielle est la même pour toutes les particules. L'énergie de Fermi pour chaque palier ne peut être qu'une énergie cinétique. Aussi paradoxal que cela puisse paraître, les particules d'un gaz de Fermi bougent quand même au zéro absolu ! On peut calculer l'impulsion de la énième particule en utilisant la formule de l'énergie cinétique, ce qui donne l'impulsion de Fermi :
On peut aussi calculer l'impulsion moyenne par nucléon, qui est égale à approximativement :
Le calcul de l'énergie de Fermi nucléaire
[modifier | modifier le wikicode]La base du modèle de gaz de Fermi est la statistique de Fermi qui donne le nombre d'états que peut prendre un fermion, s'il est confiné dans un volume V et que son impulsion est comprise entre un intervalle [ p , p + dp ] :
Le nombre d'états total est donc :
Au zéro absolu, tous les états sont remplis, tant que l'impulsion est inférieure à l'impulsion de Fermi. En notant celle-ci on a :
L'intégrale donne
Si on suppose que le noyau est sphérique, on peut utiliser les formules vues dans les premiers chapitres. Son volume est égal à , avec le volume d'un nucléon. On a alors :
On simplifie :
Dans un noyau, les protons et les neutrons sont des fermions indépendants. Il y a donc, conceptuellement, deux puits de potentiels séparés : un pour les protons et un pour les neutrons. Dans les équations précédentes, le nombre de particules n n'est pas le nombre de masse A, mais correspond approximativement soit au nombre de protons Z, soit au nombre de neutrons N. Les impulsions de Fermi sont différentes pour les protons et les neutrons. On a donc :
On peut reformuler ces équations comme suit :
On peut isoler l'impulsion de Fermi, ce qui donne :
On élève le tout à la puissance :
L'approximation Z=N
[modifier | modifier le wikicode]Dans la plupart des noyaux, on a Z = N = A/2. Nous allons supposer que cette égalité est vraie au zéro absolu, bien que ce ne soit vrai que pour les noyaux avec un A petit. L'impulsion de Fermi devient alors :
L'énergie de Fermi qui correspond vaut :
L'énergie de Fermi et le potentiel ne sont pas égaux. Le potentiel intranucléaire est égal à environ 40 MeV, alors que l'énergie de Fermi est de seulement 33 MeV. La différence n'est autre que l'énergie de liaison du noyau moyenne par nucléon. Cette dernière vaut approximativement 7 à 8 MeV. Dans les faits, cette approximation n'est pas si mauvaise.
Le cas général
[modifier | modifier le wikicode]Maintenant, reprenons les deux équations vues plus haut, avant d'utiliser l'approximation Z=N.
L'énergie de Fermi pour les protons et neutrons vaut :
Si on pose , les équations précédentes deviennent :
Le lien avec le modèle de la goutte liquide
[modifier | modifier le wikicode]Maintenant, supposons que les protons et neutrons aient la même masse, pour simplifier les calculs. Sous cette hypothèse, l'énergie totale du noyau vaut :
- , avec l'énergie moyenne par nucléon.
On suppose que l'énergie moyenne par nucléon n'est pas la même pour les protons et les neutrons. On a alors :
On confond l'énergie moyenne avec l'énergie de Fermi moyenne. Celle-ci vaut par définition . Cela donne :
Les énergies de Fermi ont été calculées plus haut. On fait donc le remplacement :
On factorise :
On simplifie les puissances :
Le terme se développe comme suit : . En combinant avec l'équation précédente, on trouve :
En développant, on a :
Le premier terme est le terme de volume dans le modèle de la goutte liquide, alors que le second est le terme de symétrie. Les autres termes ne sont pas présents en raison de l'hypothèse de base du modèle : l'absence d'interactions entre les fermions. L'absence d'interactions électrostatiques fait que l'énergie de répulsion électrostatique n'est pas prise en compte dans le modèle, alors que l'absence de la force nucléaire élimine l'énergie de surface.
Le modèle en couche du noyau
Il est maintenant temps de voir les derniers modèles abordés dans ce cours : ceux des couches nucléaires et du gaz de Fermi. Tout deux se basent sur les mêmes hypothèses, que nous développerons par la suite. Les hypothèses en question sont la quantification de l'énergie et le principe d'exclusion de Pauli. Les théories a base de couches nucléaires ont clairement de bons résultats empiriques : elles expliquent l'existence des nombres magiques, ainsi que la stabilité des noyaux avec un nombre égal de protons et de neutrons. Mais les hypothèses de ce modèle font qu'il a des limites. En premier lieu, il marche très bien pour les noyaux avec un nombre de masse petit, mais donne de mauvais résultats pour les gros noyaux.
La quantification de l'énergie
[modifier | modifier le wikicode]
Premièrement, ces modèles considèrent que le potentiel nucléaire est constant dans tout le noyau, sauf éventuellement en périphérie où il diminue très rapidement avec la distance. Ce sont donc des théories dites de champ moyen, où le vrai potentiel nucléaire (très variable selon la position des nucléons dans le noyau) est simplement remplacé par sa moyenne en tout point du noyau. La formule suivante, celle de Saxon-Woods, permet de calculer ce potentiel, en posant :
- le potentiel et est le potentiel au centre du noyau ;
- est la distance par rapport au centre du noyau ;
- est le rayon du noyau, dans la partie où le potentiel est constant ;
- est la longueur sur laquelle le potentiel chute rapidement en périphérie.
En clair, chaque nucléon est donc bloqué dans un puits de potentiel de la même manière que dans le modèle de Gamow de la radioactivité alpha. Sauf que cette fois-ci, le modèle prend en compte la physique quantique pour décrire des nucléons individuels. Celle-ci nous dit que l'énergie d'une particule dans un puits de potentiel ne peut pas prendre toutes les valeurs possibles : elle évolue par paliers, chaque palier correspondant à une valeur bien précise de la longueur d'onde de la particule. La formalisation mathématique de ce raisonnement (la résolution de l'équation de Schrödinger dans un potentiel sphérique de Saxon-Woods) donne des niveaux d'énergie bien précis pour les nucléons du noyau.
Néanmoins, comme nous l'avons vu dans le chapitre sur l'interaction nucléaire, les potentiels centraux ne permettent pas de décrire correctement l'interaction nucléaire. Il faut leur ajouter une composante tensorielle, ainsi qu'un couplage spin-orbite. Si l'on peut négliger la composante tensorielle, en première approximation, ce n'est pas le cas de la composante spin-orbite. L'interaction nucléaire dépend si fortement des spins des nucléons que l'on doit la prendre en compte dans un modèle complet. Le potentiel s'écrit donc :
- , avec le moment cinétique orbital d'un nucléon et le spin du nucléon. Le terme est une fonction des coordonnées dans le noyau.
Le principe d'exclusion de Pauli
[modifier | modifier le wikicode]Ensuite, l'état d'une particule est définie par plusieurs nombres quantiques, qui permettent de décrire totalement l'état de la particule : l'énergie de la particule et son spin en sont de bons exemples. Dans un atome ou un noyau, deux particules ne peuvent pas avoir les mêmes nombres quantiques : elles doivent avoir au moins un nombre quantique de différent. Dit autrement, si deux particules ont la même énergie (ou le même spin, le même moment angulaire), alors elles doivent avoir un de leur nombre quantique différent. C'est ce qu'on appelle le principe d'exclusion de Pauli.
Ainsi, il est possible que plusieurs nucléons aient la même énergie dans le noyau. Il suffit qu'ils aient des spins, des charges électriques ou des moments angulaires différents. Conceptuellement, tout ce passe comme si les nucléons étaient répartis sur différents niveaux d'énergie, niveaux qui acceptent un nombre limité de particules. Mais attention : le nombre de particules acceptée dépend du niveau : le premier niveau ne peut accepter que deux particules, le second en accepte 6, etc. Ces niveaux d'énergie sont aussi appelées des couches nucléaire.
Un noyau cherche à minimiser à tout prix son énergie. Pour cela, il tente de remplir les couches les plus basses, celles avec l'énergie la plus faible. Ainsi, les noyaux les plus stables sont ceux pour lesquels les couches les plus basses sont totalement remplies, les couches supérieures étant vides. Si une couche est partiellement remplie, le noyau ne sera pas aussi stable qu'un noyau avec des couches soit totalement vides soit pleines. Cela permet d'expliquer l'existence des nombres magiques : en tenant compte de la capacité des couches calculée par la théorie, on trouve que les noyaux dont le nombre de protons/neutrons est un nombre magique ont des couches totalement remplies.
Du fait de leur charge, un proton et un neutron peuvent tout deux appartenir à la même couche. Si on prend en compte les autres nombres quantiques (qui sont les communs aux deux particules), on devine que chaque couche contient un nombre égal de protons et de neutrons. Cela permet d'expliquer pourquoi les noyaux les plus stables ont tendance à avoir le même nombre de protons et de neutrons : cela permet de remplir totalement les couches nucléaires. Si jamais il y a un excès de neutrons ou de protons, cet excès sera relégué dans une couche supérieure et aura donc un plus d'énergie que s'il était dans la couche du dessous. En se désintégrant dans l'autre type de nucléon, cet excès passera dans la couche inférieure en diminuera son énergie : le noyau devient alors plus stable.
Les théories de la désintégration alpha
On pourrait croire que la désintégration alpha est une forme de fission comme une autre, mais il semblerait que ce ne soit pas le cas. Quelques observations laissent penser que le noyau doit avoir une structure interne, à savoir que les nucléons sont regroupés en paquets de nucléons fortement liés entre eux. Et les particules alpha émises lors des désintégrations alpha seraient des paquets préformés, présents dans le noyau avant la désintégration. Une désintégration a lieu quand une particule alpha acquière une énergie cinétique suffisante pour vaincre l'attraction nucléaire et sortir du noyau. Cette théorie de la radioactivité a été formalisée mathématiquement par Gamow dans le formalisme de la mécanique quantique. Nous allons donner ci-dessous un petit aperçu vulgarisé de ce modèle.
La théorie de Gamow de la désintégration alpha
[modifier | modifier le wikicode]La particule alpha possède une énergie potentielle qui est la somme de l'énergie potentielle nucléaire et de l'énergie potentielle liée à la répulsion entre protons. Pour simplifier, le potentiel nucléaire est constant dans le noyau, et nul à l'extérieur. Le potentiel électrostatique diminue avec la distance à l'extérieur du noyau et est complètement supplanté par la force nucléaire dans le noyau. Le potentiel ressemble donc à ce qui indiqué dans le schéma du dessous : il forme une sorte de puits, entouré par une barrière de potentiel.


La particule ne reste pas immobile, mais circule dans le noyau. Pour simplifier, l’intérieur du noyau est considéré comme un gaz de particules alpha et de nucléons. Dans son mouvement intranucléaire, elle se cogne régulièrement sur les autres particules alpha et nucléons. De l'énergie est échangée lors de ces collisions, ce qui fait que la particule alpha peut gagner ou perdre de l'énergie. Entre deux collisions, elle se déplace grosso-modo en ligne droite (vu que le potentiel est supposé constant). Dans son mouvement, il lui arrive de toucher la barrière de potentiel. Deux possibilités s'offrent alors : soit la particule rebondit sur la barrière de potentiel et reste dans le noyau, soit elle a suffisamment d'énergie cinétique pour la traverser. D'après les lois de la physique classique, une particule alpha sort du puits de potentiel quand elle acquiert une énergie cinétique supérieure à la barrière de potentiel. La probabilité de sortie du noyau dépend de deux choses : la fréquence des collisions sur la barrière de potentiel, et la probabilité de sortie .
Calcul de la fréquence de collision avec la barrière
[modifier | modifier le wikicode]La fréquence de collision avec la barrière de potentiel est assez simple à calculer. Il suffit de calculer le temps entre deux collisions, c'est à dire le temps pour passer d'un bout à l'autre du noyau, et l'en prendre l'inverse.
- , avec le temps entre deux collisions sur la barrière de potentiel.
Pour une particule alpha de vitesse et un noyau de rayon , ce temps est le temps mis par la particule pour parcourir le diamètre du noyau (pour passer d'un bout à l'autre) :
- , ce qui donne :
On peut relier la vitesse de la particule à son énergie cinétique et à sa masse : . En injectant dans l'équation précédente, on a :
On peut simplifier cela en :
Calcul de la probabilité de sortie lors d'une collision
[modifier | modifier le wikicode]
D'après ce calcul classique, on voit que la probabilité de sortie d'une particule alpha est proportionnelle à la racine carré de son énergie cinétique. On peut vérifier si cette expression est valide expérimentalement. Il suffit de compter le nombre de particules alpha émises en fonction de leur énergie cinétique, à savoir étudier le spectre alpha. Mais les résultats expérimentaux ne collent pas du tout avec la formule précédente. De plus, les calculs réalisés dans le cadre de la physique classique disent que la probabilité d'une désintégration alpha est très faible, bien inférieure à celle mesurée expérimentalement.
Le problème est cependant résolu dans le cadre de la physique quantique. Celle-ci dit que même si une particule n'a pas une énergie cinétique suffisante, elle a une certaine probabilité de passer à travers la barrière de potentiel : une vraie téléportation. Ce phénomène est appelé l'effet tunnel. La probabilité d'une désintégration alpha dépend donc de deux paramètres : la fréquence à laquelle la particule entre en collision avec la barrière de potentiel et la probabilité de téléportation à travers la barrière.
Les calculs réalisés dans le cadre de la mécanique quantiques nous donnent la probabilité de traversée de la barrière de potentiel. Une version précise est la suivante :
- , avec et la masse et l'énergie de la particule alpha, le rayon du noyau et Z le nombre atomique (nombre de protons).
Dans sa version la plus simple, la probabilité de traversée est égale à :
- , avec l'épaisseur de la barrière de potentiel et , avec l'énergie de la particule alpha, l'épaisseur de la barrière de potentiel et m la masse de la particule.
On peut encore résumer cette équation comme ceci :
- , avec .
On peut noter que , avec Z le nombre de protons et l'énergie de la particule alpha.
La dérivation de la loi de Geiger-Nuttall
[modifier | modifier le wikicode]Prenons l'équation précédente :
Sachant que l'on a , l'équation précédent devient :
Combinons-la avec l'équation vue au début de la section. On obtient alors la probabilité de désintégration alpha :
Prenons le logarithme de l'équation précédente :
Le logarithme d'un produit est la somme des logarithmes :
On simplifie le second terme :
On posant , on retrouve la loi de Geiger-Nuttall :
Les autres théories de la désintégration alpha
[modifier | modifier le wikicode]Par la suite, d'autres théories ont postulé que le noyau est formé d'un liquide/gaz de particules alpha. La première théorie de ce genre est celle de Hafstad et Teller, qui a été complétée depuis par d'autres modèles du même genre : le modèle des spherons, ainsi que le modèle 2D d'Ising sont les plus connus. À l'appui de ces théories, les noyaux qui ont un nombre de nucléons multiple de quatre sont nettement plus stables que les autres. De tels noyaux ont en effet une énergie de liaison par nucléon plus importante que les noyaux de A proche (en moyenne). D'après ces théories, l’énergie de liaison devait être proportionnelle au nombre de liens entre particules alpha, ce qui est observé expérimentalement. L'énergie de liaison d'un lien entre deux particules alpha serait remarquablement constante, de l'ordre de 4,5 Mev. Mais ces théories ont malheureusement quelques défauts, le principal étant qu'elles ne s'appliquent que pour les noyaux avec un A faible. En effet, qui dit noyau formé de particules alpha dit autant de protons que de neutrons. Mais cette condition n'est respectée que pour les noyaux avec peu de nucléons. Les noyaux avec beaucoup de nucléons ont des nombres de protons et de neutrons inégaux.
- Quelques expériences sur le sujet sont mentionnées dans cet article (en anglais) : Clusters in nuclei.
Les familles radioactives
- Ce chapitre est une annexe qui peut être passée en première lecture.
Dans les chapitres précédents, nous avons parlé rapidement des chaînes de désintégration, à savoir du fait que certains noyaux se désintègrent en noyaux instables, qui eux-même se désintègrent et ainsi de suite. Dans ce chapitre, nous allons étudier quatre chaînes de désintégration assez connues des physiciens. Il s'agit des chaînes qui commencent par le Thorium-232, le Neptunium-237, et l'Uranium-235 et 238. Toutes, sauf celle du Neptunium, terminent sur un isotope stable du Plomb : du Plomb 206 pour la chaîne de l'Uranium-238, du Plomb 207 pour l'Uranium-235 et du Plomb-208 pour le Thorium-232.
- Sur les schémas du chapitre, chaque flèche correspond à une désintégration. En dessous de la notation du nucléide (élément chimique, nombre de masse et de protons), se trouve la demi-vie de désintégration de l’élément.
- Chaque chaîne est de plus résumée dans un tableau qui liste chaque noyaux produit par désintégration. Le premier noyau est celui en haut du tableau et chaque passage d'une ligne traduit une désintégration.
La famille de l'Uranium-235
[modifier | modifier le wikicode]
La chaîne de L'Uranium-235 commence en réalité au Plutonium-239 et termine sur un noyau stable de Plomb-207.
| Élément chimique | Radioactivité | Demi-vie |
|---|---|---|
| Plutonium 239 | Radioactivité alpha | 24 110 années |
| Uranium 235 | Radioactivité alpha | 7 milliards d'années |
| Thorium 231 | Radioactivité bêta | 25,2 h |
| Protactinium 231 | Radioactivité alpha | 32 700 ans |
| Actinium 227 | Radioactivité bêta | 21,8 années |
| Thorium 227 | Radioactivité alpha | 18,72 jours |
| Radium 223 | Radioactivité alpha | 11,43 jours |
| Radon 219 | Radioactivité alpha | 3,96 secondes |
| Polonium 215 | Radioactivité alpha | 1,78 millisecondes |
| Plomb 211 | Radioactivité bêta | 36,1 minutes |
| Bismuth 211 | Radioactivité alpha | 2,15 minutes |
| Thallium 207 | Radioactivité bêta | 4,77 minutes |
| Plomb 207 | Stable | |
La famille de l'Uranium-238
[modifier | modifier le wikicode]
Encore une fois, la chaîne de désintégration commence à un isotope du Plutonium : le Plutonium-242. .
| Élément chimique | Radioactivité | Demi-vie |
|---|---|---|
| Plutonium 242 | Radioactivité alpha | 373 000 ans |
| Uranium 238 | Radioactivité alpha | 4,4688 milliards d'années |
| Thorium 234 | Radioactivité bêta | 24 jours |
| Protactinium 234 | Radioactivité bêta | 1,2 minutes |
| Uranium 234 | Radioactivité alpha | b245 000 ans |
| Thorium 230 | Radioactivité alpha | 75 000 ans |
| Radium 226 | Radioactivité alpha | 1602 ans |
| Radon 222 | Radioactivité alpha | 3,8 jours |
| Polonium 218 | Radioactivité alpha | 3 minutes |
| Plomb 214 | Radioactivité bêta | 27 minutes |
| Bismuth 214 | Radioactivité bêta | 20 minutes |
| Polonium 214 | Radioactivité alpha | 160 μ-secondes |
| Plomb 210 | Radioactivité bêta | 22,3 ans |
| Bismuth 210 | Radioactivité bêta | 5 jours |
| Polonium 210 | Radioactivité alpha | 138,376 jours |
| Plomb 206 | Stable | |
La famille du Thorium-232
[modifier | modifier le wikicode]
La chaîne de désintégration du Thorium-232 commence en réalité au Plutonium-244.
| Élément chimique | Rayonnement | Demi-vie |
|---|---|---|
| Plutonium 244 | Radioactivité alpha | 80 millions d'années |
| Uranium 240 | Radioactivité bêta | 14,1 heures |
| Neptunium 240 | Radioactivité bêta | 62 minutes |
| Plutonium 240 | Radioactivité alpha | 6.560 années |
| Uranium 236 | Radioactivité alpha | 23,42 millions d'années |
| Thorium 232 | Radioactivité alpha | 14,05 millions d'années |
| Radium 228 | Radioactivité bêta | 5,75 années |
| Actinium 228 | Radioactivité bêta | 6,15 heures |
| Thorium 228 | Radioactivité alpha | 1,9 années |
| Radium 224 | Radioactivité alpha | 3,63 jours |
| Radon 220 | Radioactivité alpha | 55,6 secondes |
| Polonium 216 | Radioactivité alpha | 0,145 secondes |
| Plomb 212 | Radioactivité bêta | 10,64 heures |
| Bismuth 212 | Deux voies de désintégration :
|
60,55 minutes |
| β− : Polonium 212 | Radioactivité alpha | 0,3 μ-secondes |
| α : Thallium 208 | Radioactivité bêta | 3,053 minutres |
| Plomb 208 | Stable | |
La famille du Neptunium-237
[modifier | modifier le wikicode]
La chaîne du Neptunium-237 commence encore une fois à un isotope du Plutonium : le Plutonium-241.
Seuls les deux noyaux en fin de chaîne sont observés dans la nature. Il s'agit respectivement du Bismuth-209 et du Thalium-205
| Élément chimique | Radioactivité | Demi-vie |
|---|---|---|
| Plutonium 241 | Radioactivité bêta | 14,4 années |
| Américium 241 | Radioactivité alpha | 432,7 années |
| Neptunium 237 | Radioactivité alpha | 2 140 000 années |
| Protactinium 233 | Radioactivité bêta | 27 jours |
| Uranium 233 | Radioactivité alpha | 159 000 années |
| Thorium 229 | Radioactivité alpha | 75 400 années |
| Radium 225 | Radioactivité bêta | 14,9 jours |
| Actinium 225 | Radioactivité alpha | 10 jours |
| Francium 221 | Radioactivité alpha | 4,8 minutes |
| Astate]] 217 | Radioactivité alpha | 32 millisecondes |
| Bismuth 213 | Radioactivité alpha | 46,5 minutes |
| Thallium 209 | Radioactivité bêta | 2,2 minutes |
| Plomb 209 | Radioactivité bêta | 3,25 heures |
| Bismuth 209 | Radioactivité alpha | 19 milliards de milliards d'années |
| Thallium 205 | Stable | |
 GFDL GFDL
|
Vous avez la permission de copier, distribuer et/ou modifier ce document selon les termes de la licence de documentation libre GNU, version 1.2 ou plus récente publiée par la Free Software Foundation ; sans sections inaltérables, sans texte de première page de couverture et sans texte de dernière page de couverture. |






































































![{\displaystyle R={\sqrt[{3}]{A\times r_{n}^{3}}}={\sqrt[{3}]{A}}\times r_{n}=A^{\frac {1}{3}}\cdot r_{n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/241d482ad9af219ce602a598b5f4a46b64b3c252)






















![{\displaystyle \ln {\left[{\frac {\rho _{0}}{\rho (r)}}-1\right]}={\frac {r-R}{a}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6cdcd3863baedd39baf5068ec39ed9a53c753f7b)
![{\displaystyle a\cdot \ln {\left[{\frac {\rho _{0}}{\rho (r)}}-1\right]}=r-R}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6abe6760a86e8c02de76b614e91d38bbed850de8)
![{\displaystyle a\cdot \ln {\left[{\frac {\rho _{0}}{\rho (r)}}-1\right]}+R=r}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e45d3c94e03e5617ccd5af5d8d84b80dd28926d0)




![{\displaystyle r_{1}=a\cdot \ln {\left[{\frac {1}{0.9}}-1\right]}+R=a\cdot \ln {\left({\frac {1}{9}}\right)}+R=a\cdot \ln {-9}+R=-a\cdot \ln {9}+R}](https://wikimedia.org/api/rest_v1/media/math/render/svg/658dbb3100018441d6e55ae2b53f70bc33dc094c)
![{\displaystyle r_{2}=a\cdot \ln {\left[{\frac {1}{0.1}}-1\right]}+R=a\cdot \ln {(9)}+R}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58810be7a47303fb15a123589ddf2dabdaa5b273)

![{\displaystyle e=\left[a\cdot \ln {9}+R\right]-\left[-a\cdot \ln {9}+R\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f8b4629ed91e3626a5c1ed0b630b8950c202b79)








































![{\displaystyle -{\frac {dE}{dx}}={\frac {4\pi nz^{2}}{m_{e}v^{2}}}\cdot \left({\frac {e^{2}}{4\pi \varepsilon _{0}}}\right)^{2}\cdot \left[\ln \left({\frac {2m_{e}v^{2}}{I}}\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f50e5989e8f6744815a969aa45720d272e190c00)

![{\displaystyle -{\frac {dE}{dx}}={\frac {4\pi }{m_{e}c^{2}}}\cdot {\frac {nz^{2}}{{\frac {v}{c}}^{2}}}\cdot \left({\frac {e^{2}}{4\pi \varepsilon _{0}}}\right)^{2}\cdot \left[\ln \left({\frac {2m_{e}c^{2}{\frac {v}{c}}^{2}}{I\cdot (1-{\frac {v}{c}}^{2})}}\right)-{\frac {v}{c}}^{2}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/37c3fe40182a1af8383d3c07a84221fd4ed18aad)































































































































































































































![{\displaystyle N_{n}(t)=\sum _{i=1}^{n}\left[N_{i}(0)\times \left(\prod _{j=i}^{n-1}\lambda _{j}\right)\times \left(\sum _{j=i}^{n}\left({\frac {e^{-\lambda _{j}t}}{\prod _{p=i,p\neq j}^{n}(\lambda _{p}-\lambda _{j})}}\right)\right)\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90ffcaa35afc24978f9039c036b4e77933c8ff72)





























































![{\displaystyle E_{l}=\left[a_{v}A+a_{s}A^{\frac {2}{3}}+a_{a}A\right]-Z\cdot \left[4a_{a}\right]-Z^{2}\left[{\frac {a_{c}}{A^{1/3}}}+{\frac {4a_{a}}{A}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b26ea42c811d7d8f5da6e4aab9f500494e0a74f)






































![{\displaystyle p_{F}^{Z}={\frac {h}{r_{n}}}\left({\frac {9}{16\pi ^{2}}}\right)^{\frac {1}{3}}\left[{\frac {Z}{A}}\right]^{\frac {1}{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4bd0bbe25546286d32385fe1e83f2ce457d77ae3)
![{\displaystyle p_{F}^{N}={\frac {h}{r_{n}}}\left({\frac {9}{16\pi ^{2}}}\right)^{\frac {1}{3}}\left[{\frac {N}{A}}\right]^{\frac {1}{3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b4556cb80f31058827638510c31e884fe2c7b82f)
![{\displaystyle p_{F}={\frac {h}{r_{n}}}\left({\frac {9}{16\pi ^{2}}}\right)^{\frac {1}{3}}\left[{\frac {1}{2}}\right]^{\frac {1}{3}}\approx 250MeV/c}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d65104b0584e07dd613eb751fd38d7a9f79d074)


















![{\displaystyle E_{totale}\approx K\left[A+{\frac {5}{9}}{\frac {(N-Z)^{2}}{A}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5415a07128bb798f5535e76cb7fd8a72313c5bbc)















![{\displaystyle P=exp\left[-{\frac {4em_{a}}{\hbar \pi \epsilon _{0}}}^{\frac {1}{2}}R_{0}^{\frac {1}{2}}(Z-2)^{\frac {1}{2}}-{\frac {e^{2}m_{a}}{\hbar \epsilon _{0}}}^{\frac {1}{2}}(Z-2)E_{a}^{-{\frac {1}{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f847127cac742922a03c27a43c900000b703ff4)















