Wikijunior:Les éléments/Structure
Structure
[modifier le wikicode]
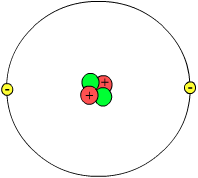
Les protons, les neutrons et les électrons engendrent les atomes. A cause de ceci, ils sont appelés particules subatomiques. Chaque type d'atome peut différer dans le nombre de protons, de neutrons et d'électrons. Selon la théorie atomique actuelle des nuages d'électrons, il existe deux parties dans l'atome, le noyau et le nuage d'électrons. Le noyau est constitué de protons et de neutrons. A leur tour, chacune de ces particules est composée de trois particules encore plus petites que l'on appelle des "quarks".
Le noyau est le centre de l'atome et contient les protons et les neutrons. Le noyau est très petit comparé à la taille du nuage d'électrons. Ce qui signifie qu'il existe un espace vide autour du noyau. Les protons et les neutrons d'un atome sont situés à des emplacements précis.
Les protons et les électrons contiennent de l'électricité. On dit qu'ils sont chargés. Les protons ont une charge positive. Le nombre de protons décide de la nature de l'atome, de quel élément il s'agit. Par exemple, si un atome a un proton (chargé +), il aura un électron autour de lui (chargé -), un peu comme deux aimants microscopiques, cela signifie que c'est l'élément Hydrogène ; seul l'Hydrogène peut avoir un proton. Sur le tableau périodique, le nombre atomique d'un élément est le même que son nombre de protons.
Les neutrons n'ont pas de charge, ils aident à stabiliser le noyau ; si les charges positives des protons étaient seuls dans le noyau, ils se repousseraient les uns les autres, comme des cotés d'aimants de même signe, et rendraient le noyau moins stable. Les éléments avec des nombres différent de neutrons mais le même nombre de protons sont appelés des isotopes. Par exemple, l'Hydrogène a trois isotopes, un avec un neutron, un avec deux neutrons et un avec trois neutrons. Ils ont tous un proton et donc, ils sont tous de l'Hydrogène, mais parce qu'ils diffèrent par leur nombre de neutrons, ce sont des isotopes différents. Certains isotopes sont radioactifs, ce qui signifie qu'ils perdent leurs neutrons supplémentaires avec le temps. Un certain isotope radioactif du Carbone, appelé Carbone-14 est utilisé par les paléontologistes pour découvrir et déterminer l'age des fossiles. Ils peuvent faire cela parce qu'ils connaissent le taux de décroissance du Carbone-14.
La partie extérieure de l'atome, ou le nuage d'électrons entoure le noyau. Maintenant, selon une théorie appelée la Mécanique Quantique, nous ne connaissons jamais la position exacte ou la vitesse d'un électron précis; ce principe s'appelle le principe d'incertitude d'Heisenberg, du nom du physicien qui l'a énoncé. Il dit simplement que si nous connaissons exactement la vitesse nous n'aurons pas la position et si nous connaissons exactement la position, nous ne connaissons pas la vitesse. Par conséquent, nous ne pouvons simplement dire que la probabilité qu'il est n'importe où. Les électrons ont une charge négative. Certains scientifiques ont d'abord pensé que les électrons orbitaient autour du noyau comme des planètes autour du soleil, mais nous savons maintenant que ce la n'est pas vrai. Les électrons bougent aléatoirement autour du noyau et sont attirés par les charges positives des protons dans le noyau. Ils permettent aux atomes d'être liés ensemble pour former les molécules.
Les atomes = blocs de construction
[modifier le wikicode]Les atomes sont la base de la chimie. Ils sont aussi la base de tout ce qui existe dans l'univers. Il faut se rappeler que la matière est composée d'atomes. Les atomes et l'étude des atomes sont un monde à part entière. Nous couvrons les bases de la structure atomique et des liaisons entre les atomes.
L'arrangement électronique
[modifier le wikicode]
Qu'est-ce qui maintient tous les électrons en place ? Réponse : les niveaux d'énergie. Ces niveaux d'énergie ont des petits compartiments à l'intérieur dans lesquels les électrons sont gardés. Ils sont appelés les orbitales. Chaque orbitale peut contenir deux électrons.
- Dans le premier niveau d'énergie, il existe une orbitale au maximum, donc, deux électrons peuvent être contenus dans le premier niveau d'énergie.
- Dans le deuxième niveau d'énergie, il existe quatre orbitales au maximum, donc huit électrons peuvent être contenus dans le deuxième niveau d'énergie.
- C'est la même chose dans le troisième niveau d'énergie.
- On en sait moins sur le quatrième niveau et les suivants.
Comme expliqué au-dessus, certains atomes ont seulement une certaine quantité d'électrons, donc certains éléments n'ont pas autant d'orbitales ou de niveaux d'énergie que les autres.
