Systèmes sensoriels/Poisson
Introduction
Système auditif
Système vestibulaire
Système somatosensoriel
Système olfactif
Système gustatif
Poisson-zèbre : Calcul neuronal dans l’Ampoule Olfactive du Poisson-Zèbre
[modifier | modifier le wikicode]Le système olfactif du poisson-zèbre
[modifier | modifier le wikicode]
Le poisson-zèbre (Danio rerio) est un téléostéen d’eau douce originaire d’Asie du Sud-Est [1]. L’eau coule à travers son nez de façon laminaire et unidirectionnelle. Même lorsque le poisson-zèbre n’est pas en mouvement, les cils mobiles permettent le passage continu d’informations odorantes dans un flux d’eau. C’est ainsi que le poisson-zèbre peut cartographier l’espace olfactif en se déplaçant dans son environnement. Le premier relais de transmission de l’information odorante se trouve dans l’ampoule olfactive. Le passage de l’information par l’ampoule olfactive est un processus extrêmement complexe qui implique de multiples transformations à travers le circuit neuronal. Par exemple, une odeur composée de différentes molécules activera un groupe spécifique de récepteurs odorants sur les neurones sensoriels olfactifs qui sont disposés sur l’extrémité de l’ampoule olfactive sous la forme d’un réseau de glomérules. Ainsi, une odeur est encodée par une combinaison des signaux d’activation des glomérules. L’ampoule olfactive d’un poisson-zèbre adulte contient environ 140 glomérules stéréotypés [2]. Un glomérule est une unité fonctionnelle composée de connections synaptiques entre trois classes cellulaires (Figure 1) [3].
- Les neurones sensoriels olfactifs entrants exprimant le même récepteur olfactif. Toutes les connexions synaptiques sont excitatrices.
- Les interneurones inhibiteurs à l’origine des multiples transformations du signal olfactif. Chez le poisson zèbre, ces interneurones peuvent être subdivisés en trois types de cellules ayant chacune des caractéristiques morphologiques distinctes : périglomérulaire, granulaire et à axone court.
- Les cellules mitrales, qui relaient le signal reçu par l’ampoule olfactive vers les zones cérébrales supérieures. Chez le poisson-zèbre adulte, on compte environ 1 500 cellules mitrales. 70 % de ces cellules mitrales ne reçoivent la contribution que d’un seul glomérule [4].
Figure 1 : Schéma des types de cellules se trouvant dans l’ampoule olfactive du poisson-zèbre. Cellule à axone court (SAC), Neurones sensoriels olfactifs (OSN), Cellules granulaires (GC), Cellules periglomérulaires (PGC).
Pour le système olfactif, il est difficile d’identifier des champs récepteurs équivalents à ceux du système visuel. Comme décrit ci-dessus, un glomérule reçoit en entrée uniquement des stimuli des neurones sensoriels olfactifs exprimant le même récepteur odorant. C’est ainsi qu’une carte chimiotopique spatiale se répartit sur l’ensemble de l’ampoule olfactive. En d'autres termes, différents types d'odeurs naturelles au poisson-zèbre (acides aminés, acides biliaires, nucléotides) activent différents domaines anatomiques de l’ampoule olfactive [1].
Décorrélation des patterns
[modifier | modifier le wikicode]
La décorrélation des patterns est une étape de calcul qui se produit dans les glomérules du poisson-zèbre. Celle-ci réduit les recouvrements entre les signaux d’activation représentant des odeurs similaires. Prenons par exemple deux senteurs similaires telles que l’essence de graine de cumin et l’essence de graine de fenouil. Du fait de leurs compositions moléculaires similaires, les deux senteurs activent des signaux glomérulaires similaires. Initialement ces signaux d’activation sont donc fortement corrélés. En d'autres termes, les odorants ayant des caractéristiques moléculaires similaires activent des combinaisons de glomérules à superposition partielle Puis la majorité des corrélations sont éliminées et l’activité glomérulaire est redistribuée pour revenir à un état stable. La décorrélation des patterns est une première étape utile à de nombreuses procédures de classification. Dans le cas d’un classificateur optimal, elle n’apporte pas d’information supplémentaire sur la représentation olfactive et n’augmente pas sa performance. C’est plutôt la performance des classificateurs sous-optimaux qu’elle améliore, en agrandissant la zone de tolérance (Figure 2) [5]. Ce processus peut être important pour les systèmes nerveux dans le cadre de l’apprentissage olfactif et donc de l’identification des odeurs [1].



Les patterns d’activité glomérulaire stimulés par une odeur peuvent être visualisés en introduisant des capteurs de calcium dans les neurones sensoriels olfactifs [6]. Ce processus a été employé sur des poissons-zèbres pour analyser des patterns d’activité glomérulaire stimulés par 16 acides aminés qui appartiennent au spectre olfactif naturel du poisson-zèbre. Pour étudier la décorrélation des patterns, les réactions à trois acides aminés similaires (Phe, Tyr ou Trp) ont été mesurées sur les cellules mitrales par une imagerie calcique multiphotonique. L’imagerie calcique multiphotonique révèle qu’initialement, les patterns d’activité situés dans des groupes de cellules mitrales voisins se recouvrent. Par la suite, ce phénomène s’estompe car des sous-ensembles de ces cellules mitrales deviennent moins actives voire muettes. Cela résulte en une diminution locale, et non globale, de leur activité. Parallèlement, l’activité inhibitoire des interneurones augmente et gagne en densité. La Figure 3 illustre des mesures de l’activité des cellules mitrales avant et après l’exposition d’un poisson-zèbre à deux types d’odorant différents.
Autres méthodes possibles pour la décorrélation des patterns
[modifier | modifier le wikicode]- Décorrélation induite par seuillage à récurrence améliorée (reTIDe)
Des méthodes analytiques et des simulations ont démontré que des réseaux stochastiques composés d’éléments rectificateurs (SNOREs) dotés de poids synaptiques uniformes peuvent décorréler des patterns entrants spécifiques par une méthode appelée reTIDe [1]. Cette dernière démarre par un seuillage du signal d’entrée. Les SNOREs sont composés d’unités de seuillage connectées de façon aléatoire par les synapses aux poids uniformes. Pour tout pattern positivement corrélé et à distribution normale, cette non-linearité mène dans tous les cas à une décorrélation qui augmente de manière monotone en fonction du seuil [7]. Les patterns ayant subi le seuillage sont ensuite injectés dans le réseau par des connections récurrentes, amplifiant ainsi la décorrélation jusqu’à ce qu’un état stable soit atteint. Pour une preuve et analyse mathématique, se conférer à la section « ONLINE METHOD » de la publication référencée [7].
- Optimisation d’une matrice de poids pour modéliser l’activité des interneurons
W est une matrice de poids qui représente l’activité des interneurones entre les cellules mitrales. Chaque élément représente la force de la connectivité entre deux cellules mitrales. X(t) est une matrice qui représente les taux de déclenchement des stimuli 1 et 2 de chaque cellule mitrale individuelle à un instant t. En accumulant de plus en plus de données sur X au fil du temps, il est probable que la matrice des poids W puisse être optimisée.
Conclusion
[modifier | modifier le wikicode]La décorrélation des patterns dans l’ampoule olfactive est une étape de calcul observable chez le poisson-zèbre. En revanche, aucun modèle mathématique proposé jusqu’ici n’a pu expliquer la décorrélation des patterns sur un plan mécanique. Une modélisation de l’interaction des neurones inhibiteurs et excitateurs dans l’ampoule olfactive aiderait à mieux comprendre la décorrélation des patterns à une échelle neuronale. En somme, un tel modèle nécessiterait de cartographier l’intégralité de la connectivité de l’ampoule olfactive. Atteindre un tel objectif dans les prochaines années dépendra principalement de l'acquisition de grandes quantités de données grâce à des techniques de microscopie électronique à balayage et de la reconstruction dense de ces données acquises avec la microscopie électronique.
Remerciements
[modifier | modifier le wikicode]Nous exprimons notre gratitude toute particulière au du Prof. Rainer Friedrich pour ses conseils sur cette étude.
Cétacés à dents : Écholocalisation
[modifier | modifier le wikicode]Introduction
[modifier | modifier le wikicode]
Les mammifères marins tels que les baleines, les dauphins et les marsouins ont développé des capacités sensorielles qui leur ont permis de nager en mer profonde et de coloniser les océans à travers le monde. Ces mammifères font partie de l’ordre des cétacés. Les cétacés à dents (odontocètes), micro-ordre des cétacés incluant au moins 71 espèces dont font partie les cachalots, les orques, les marsouins et les dauphins, ont acquis une capacité sensorielle remarquable, appelée écholocalisation. Ce mécanisme leur permet naviguer et de chasser leurs proies dans des zones de grande profondeur et à forte turbulence, où la visibilité est limitée. Des études ont montré que cette capacité leur donne une vision tridimensionnelle de leur environnement et, de plus, leur permet de différencier et de reconnaître les caractéristiques de divers éléments, ce qui est un avantage biologique non négligeable [8]. L’écholocalisation a ainsi joué un rôle majeur dans le succès évolutif des cétacés à dents, une espèce apparue il y a 34 millions d’années. Cependant, l’écholocalisation n’est pas uniquement présente chez les cétacés à dents, mais aussi chez toutes sortes d’animaux. Les chauves-souris microchiroptères, par exemple, ont une écholocalisation extrêmement développée, tout comme les musaraignes, deux types d’oiseaux et les chauves-souris mégachiroptères qui font aussi appel à cette capacité sensorielle [9].
Écholocalisation
[modifier | modifier le wikicode]Principes de l’écholocalisation
[modifier | modifier le wikicode]Le principe de base de l’écholocalisation est d’obtenir de l’information sur l’environnement grâces aux échos des ondes sonores émises (cf. Figure 4). Les odontocètes produisent des clics sous formes d’impulsions à haute fréquences entre 10 kHz et 200 kHz. Ces clics sont pour la plupart dans le spectre ultrasonique (>22.1 kHz) et sont ainsi imperceptibles pour les êtres humains. La durée, la fréquence, l’intervalle et le niveau d’émission des impulsions créées varient d’espèce en espèce, et dépend des variations de l’environnement comme le bruit ambiant, les réverbérations, la distance et les caractéristiques de la cible [10]. Par exemple, les cachalots utilisent un spectre de 10-30 kHz pour l’écholocalisation, tandis que les marsouins et de nombreux dauphins émettent des ondes de plus de 100 kHz [11]. Une fois qu’une onde reflétée est détectée, le délai et l’intensité de celle-ci sont exploités pour acquérir de l’information sur la distance et l’orientation du signal entrant. Les odontocètes peuvent faire varier, de manière dynamique, l’intervalle et le niveau d’émission des signaux transmis. En général, les clics sont émis à une fréquence qui permet au signal de revenir avant que le prochain ne soit émis. Ainsi, la fréquence des répétitions augmente au fur et à mesure que la cible s’approche. De plus, l’amplitude des clics et généralement plus élevée lorsque la cible est loin et diminue lorsque celle-ci approche.
Fonction
[modifier | modifier le wikicode]L’écholocalisation chez les cétacés à dents est utilisée pour leur orientation et donc pour parcourir les océans. La détection , la localisation, la différenciation et reconnaissance des éléments dans les milieux environnants leur permet de chasser leurs proies et d’éviter les prédateurs [11]. Des études suggèrent que chez certaines espèces, par ex. les dauphins d’Hector, les ondes produites sont aussi utilisées dans un contexte social [12].
Mécanismes de production du son
[modifier | modifier le wikicode]
Les sons à haute fréquence générées par les odontocètes sont produits par une structure appelée museau de singe ou lèvres phoniques (MLDB), qui se situe dans le conduit nasal supérieur. Cette structure est constituée des bourses dorsales grasses, du museau du singe, des cartilages de la bourse et du ligament de l'évent. En faisant passer l’air à travers le museau du singe, le complexe MLDB se met à vibrer et donc à générer un son. Le son est propagé par un organe ovale de tissu gras occupant la majeure partie de la tête appelé le melon, qui agit comme un miroir acoustique en concentrant les rayons sonores devant l’animal (cf. Figure 5) [9]. Le melon contient des graisses composées de lipides graisseuses. Ces lipides sont aussi appelés le tissu acoustique, à cause de leur bonne conductivité sonore et de leur rôle dans la focalisation des rayons sortants. Une étude par Aroyan [13] a montré qu’en plus du melon, le crâne et les bourses dorsales (sacs d’air) jouent aussi un rôle important dans la formation du faisceau sonore qui est propagé dans l’eau. Les sacs d’air se chargent de réfléchir tous les rayons sonores verticaux, tandis que les conduits nasaux et le crâne réfléchissent les sons orientés vers l’arrière [14]. On peut noter que ce processus se produit chez tous les odontocètes, sauf les cachalots. La structure de leur tête et donc de leur production sonore et de leur ouïe diffèrent de celles des dauphins et autres cétacés à dents, et sont l’objet de recherches en cours.
Mécanismes de réception du son
[modifier | modifier le wikicode]Les odontocètes ont la capacité remarquable de pouvoir entendre un large spectre de fréquences, allant même au-delà des 100 kHz. L’appareil dédié à la réception des signaux acoustiques se situe sur la mandibule inférieure (cf. Figure 5). La partie arrière de la mandibule est constituée d’un petit os fin, qui est directement connecté à la bulle auditive par un canal de gras. La bulle auditive, ou complexe tympano-pétreux, est composée de l’oreille moyenne (bulle tympanique) et de l’oreille interne (bulle périodique). Mis à part sa connexion avec la mandibule, le complexe tympano-pétreux est entièrement isolé du crâne, ce qui est important lors de la localisation du son sous l’eau [15]. Le signal se propage de l’oreille moyenne, remplie de tissu acoustique, à l’oreille interne. A l’intérieur de l’oreille interne, les cellules ciliées de la cochlée sont stimulées et convertissent le signal acoustique en signal électrique nerveux. Ces cellules ciliées sont connectées aux cellules ganglionnaires qui relaient les signaux électriques au cerveau via le nerf auditif. Il existe des différences significatives entre la structure de cette oreille comparée à celle d’un être humain ou celle d’autres mammifères. Celle-ci se caractérise par un nerf auditif plus long, une membrane basale plus longue, des canaux semi-circulaires plus petits et un ratio de ganglion par cellule ciliée plus élevé [16]. Le délai entre l’émission des clics et la réponse auditive, aussi appelé latence , ne dure pas plus de 7-10μsec. Cette réponse auditive du système nerveux est plus rapide que celle d’un rat, malgré le fait qu’un rat ait une tête beaucoup plus petite.
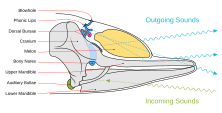
La localisation du son, c’est-à-dire la capacité à détecter la direction et la distance d’un son entrant varie fortement en fonction du moyen de propagation. Chez les mammifères terrestres la localisation se fait grâce aux indices binauraux, c’est-à-dire la différence de temps interaural et la différence d’intensité du son. Des études montrent que les odontocètes procèdent de la même manière. Ces études postulent que la haute précision de la localisation sous-marine du son chez les cétacés à dents est due à un large espacement entre leurs oreilles et au fait que celles-ci soit séparées du crâne. Le son est capté à travers le tissu de la mandibule, contrairement aux mammifères terrestres qui captent le son grâce à leurs tympans, ce qui permet de réduire les pertes d’intensité du son due à la forte pression ambiante dans les eaux profondes. Une caractéristique particulière du rayon sonore émis est qu’il n’est pas homogène, c’est-à-dire que seuls les signaux se propageant le long de l’axe horizontal ne sont pas déformés. Ainsi, les éléments se trouvant sur la direction de l’axe majeur du rayon émis seront les plus faciles à détecter.
Son transmis et caractéristiques des signaux
[modifier | modifier le wikicode]Les sons émis par les baleines à dents sont parmi les plus forts du règne animal avec des amplitudes crête à crête qui peuvent aller jusqu’à 225dB. On distingue deux types odontocètes selon leur signaux d’écholocalisation: les odontocètes siffleurs (la plupart des dauphins) avec des clics plus courts de 40-70μsec et d’une bande passante de 100 kHz, et les odontocètes non siffleurs (cachalots, dauphin d’Hector) qui ont des sons plus long de 120-200μsec avec une bande passante aux alentours de 10 kHz [17]. La portée de détection maximale varie d’une espèce à l’autre. Des expériences ont montré que cette portée est de 113m chez les grands dauphins et de 26m chez les marsouins communs. Les cachalots, quant à eux, peuvent détecter des éléments jusqu’à 500m. Néanmoins, ces chiffres sont à prendre avec précaution, car ces mesures sont difficiles à comparer comme elles dépendent fortement des variables environnementales, tel que le bruit ambiant ou les turbulences.
Autres sens
[modifier | modifier le wikicode]Odorat et goût
[modifier | modifier le wikicode]Les baleines à dents ne possèdent ni bulbes olfactifs ni organe voméro-nasal, ce qui implique une absence d’odorat. Certains odoncètes comme le grand dauphin sont dotés de papilles gustatives, mais celles-ci ont disparu chez la plupart des espèces. On peut donc supposer que la perception du goût chez les odontocètes est très faible voire inexistante. Cependant, des études montrent que les baleines à dents ont développé des organes sensoriels additionnels pour pallier leur manque de perception du goût, puisqu'elles réagissent à la présence de certaines substances dans l’eau environnante [18].
Vue
[modifier | modifier le wikicode]Bien que la vision sous-marine soit possible, les odontocètes ne dépendent que peu de leur vue. Leurs yeux peuvent s’adapter au changement d’environnement sous-marin : les globules oculaires et les cornées sont plus plats que ceux des mammifères terrestres, ce qui leur permet la réception de plus de lumière. Pour une vision maximale, leurs pupilles sont plus larges et la lumière entrante est reflétée deux fois à travers une couche réfléchissante appelée tapetum lucidum. Cette couche réfléchissante est principalement constituée de bâtonnets et n’a que peu de cônes. La perception des couleurs chez les baleines à dents s’en trouve fortement réduite [19]. Lorsqu’elles sont à la surface, les pupilles des baleines à dents se rétrécissent pour éviter d’être endommagées par la lumière du jour. De plus, des glandes sécrètent une huile qui entretient et protège les globules oculaires. Les baleines à dents peuvent voir jusqu’à 10,7m devant elles sous l’eau, mais un peu moins à la surface [18].
Toucher
[modifier | modifier le wikicode]La peau des baleines à dents est mince et très sensible. Les zones les plus sensibles se situent autour de la tête, du ventre, des organes génitaux et des nageoires. Le toucher joue un rôle important dans la communication, par exemple deux corps se touchent pour se saluer, ou pour d’autres fonctions sociales [20].
Géomagnétisme
[modifier | modifier le wikicode]Les baleines à dents ont aussi un sens dédié au géomagnétisme. En plus de l’écholocalisation, la navigation s’opère en détectant le champ électromagnétique terrestre durant les traversées des océans. Des chercheurs l’ont prouvé en étudiant leurs mouvements qui s’alignent la plupart du temps sur les lignes du champ électromagnétique terrestre. Il est postulé que le flux du champ magnétique est utilisé par les odontocètes de deux manières : le champ magnétique local est perçu comme une carte topographique formée de contours qui sont parallèles au parcours des baleines. Les baleines mettent à jour leur position sur cette carte en mesurant les constantes fluctuations de ce champ. Les échouages de baleines semblent être liés à cette capacité sensorielle, et sont causés par des fluctuations irrégulières du champ, par exemple par les sonars militaires, les tempêtes solaires, ou bien lorsque leur parcours se heurte à la terre ferme [21].
Sens tactile par système de lignes latérales
[modifier | modifier le wikicode]Introduction
[modifier | modifier le wikicode]Les poissons sont un règne animal d’une grande diversité. Il existe plus de 32000 espèces de poissons, ce qui en fait le plus grand groupe de vertébrés.
La plupart des poissons possèdent des organes sensoriels très développés. Les yeux de la majorité des poissons pélagiques et des récifs sont capables de distinguer les couleurs. Certains peuvent même percevoir le spectre ultraviolet. Les poissons possèdent aussi un très bon sens olfactif. Par exemple les truites possèdent des narines sur leur tête qui leur permettent de détecter des substances chimiques présentent dans l’eau en petite quantité. Lors de leur migration des océans vers les fleuves, les saumons utilisent leur odorat pour reconnaître leur cours d’eau de naissance. Enfin, les poissons de fonds marins ont un sens tactile très développé autour de leurs lèvres et leurs barbeaux. C’est aussi ici que se trouvent leurs papilles gustatives. Ils utilisent ainsi leur toucher et leur odorat pour trouver de la nourriture dans les fonds marins ou dans les eaux troubles.

Les poissons sont aussi dotés du système de lignes latérales, aussi appelé system lateralis. Il s’agit d’un organe méchanosensoriel situé situé autour de la tête et sur les flancs. Cet organe sert à détecter les mouvements et les vibrations dans l’eau environnante.
Fonction
[modifier | modifier le wikicode]Les poissons utilisent leur ligne latérale pour détecter les proies, les prédateurs et les changements de courant, mais aussi pour s’orienter et éviter les collisions lorsqu’ils nagent en banc.
Coombs et. coll. ont montré[22] que la ligne latérale permet aux poissons d’ajuster leur orientation vers leur proies. Les poissons s’orientent en fonction des vibrations détectées, qui sont générées par leurs proies, ou, dans le cas d’une expérience, par une sphère métallique vibrante, et ce même lorsqu’ils ont été aveuglés. Une inhibition de la transduction des signaux des lignes latérales peut être effectuée en y appliquant du chloride de cobalt, ce qui diminue fortement la capacité des poissons à détecter une proie.
En 1976, Pitcher et. coll. ont montré que des poissons aveuglés pouvaient continuer à nager en banc, alors que ceux avec une ligne latérale neutralisée ne le pouvaient pas, ce qui démontre que les poissons dépendent de leur ligne latérale pour nager en banc sans collision[23].
Anatomie
[modifier | modifier le wikicode]
On peut deviner les lignes latérales comme deux lignes qui parcourent les flancs du corps du poisson, de la tête jusqu’à la queue. Ces lignes sont constituées d’une série de cellules méchanoréceptrices appelées neuromastes. Celles-ci se trouvent soit à la surface de la peau ou, plus fréquemment, au sein du canal de la ligne latérale. Ce canal, rempli de mucus, se trouve sous la peau et transduit les variations hydrodynamiques des ouvertures sur l’extérieur vers les neuromastes à l’intérieur (cf. Figure 7). Les neuromastes sont elles-mêmes composées de cellules sensorielles avec des cellules ciliées ancrées dans une cupule gélatineuse cylindrique. Celles-ci sont soit directement en contact avec l’eau (surtout chez les poissons d’eau profonde), soit connectées au liquide lymphatique du canal latéral. Les changements hydrodynamiques fléchissent la cupule ainsi que les cellules ciliées à l’intérieur. De la même façon que les cellules ciliées dans les oreilles des vertébrés, une déviation vers les cils courts entraîne une hyperpolarisation (baisse du taux de déclenchement) alors qu’une déviation dans le sens inverse entraîne une dépolarisation (augmentation du taux de déclenchement) des cellules sensorielles. Ainsi, une représentation des changements hydrodynamiques est transduite, via un signal digital encodé par les variations du taux de déclenchement, le long de la ligne latérale vers le cerveau. L’intégration de neuromastes en grande quantité, autant sur les connections afférentes qu’efférentes, permet la création de circuits neuronaux complexes. Ces circuits peuvent ainsi réagir à des fréquences de stimulation différentes ce qui leur permet d’encoder des paramètres divers, tel que l’accélération ou la vitesse[24].

Chez les requins et les raies, certains neuromastes ont évolué d’une manière intéressante. Ceux-ci sont devenus des électrorécepteurs appelés ampoules de Lorenzini. Ces récepteurs sont concentrés autour de la tête du poisson et peuvent détecter des variations de stimulations électriques de l’ordre du 0,01 microvolt[25]. Grâce à cet appareil de mesure, ces poissons sont capables de percevoir des potentiels électriques infiniment petits générés par des contractions musculaires, ce qui leur permet de mieux chasser leur proies sur de grandes distances, même dans les eaux troubles ou bien sous le sable. Il a été postulé que les requins utilisent aussi ce sens pour mieux s’orienter et lors de leur migration, vu que les ampoules de Lorenzini sont assez sensibles pour détecter le champ magnétique terrestre.
Évolution convergente
[modifier | modifier le wikicode]Céphalopodes
[modifier | modifier le wikicode]Les céphalopodes tel que les calmars, les pieuvres et les seiches ont des cellules ciliées épidermiques sur la tête et les bras semblables aux lignes latérales des poissons. Des mesures électrophysiologiques prises sur les lignes de la sèche commune (Sepia officinalis) et le calmar court (Lolliguncula brevis) ont pu montrer qu’il s’agit bien d’un équivalent, pour les invertébrés, aux méchanorécepteurs des lignes latérales des poissons et des amphibiens aquatiques[26].
Crustacés
[modifier | modifier le wikicode]Une autre convergence à la ligne latérale peut être observée chez certains crustacés. Contrairement aux poissons, les cellules mécanosensorielles ne se trouvent pas le long du corps, mais plutôt le long de leurs antennes à intervalle régulier. Ces antennes sont fixées parallèlement au corps, et forment donc deux lignes latérales équivalentes à celles des poissons, même si elles sont mécaniquement indépendantes du reste du corps[27].
Mammifères
[modifier | modifier le wikicode]Chez les lamantins , le corps est couvert de poils tactiles, à l’exception de la tête. Ces poils sont similaires aux poils mécanosensoriels des rats-taupes nus. Cet ensemble de poils est comparable à la ligne latérale des poissons et compense les déficiences visuelles des lamantins. De la même façon, les moustaches des phoques communs peuvent détecter de minuscules mouvements dans l’eau et forment un réseau de récepteurs hydrodynamiques. Néanmoins, ce système est bien moins sensible que la ligne latérale des poissons[28].
Requins : électroception
[modifier | modifier le wikicode]Introduction
[modifier | modifier le wikicode]Les requins sont parmi les animaux les plus anciens de la planète (les premiers requins sont apparus il y a 420 millions d’années). Ils appartiennent aux Elasmobranchii, une sous-classe des Chondrichthyes (poisson cartilagineux) qui regroupe les requins et les raies. Les Elasmobranchii sont caractérisés entre autres par le fait que contrairement à d’autres types de poisson, ils ne possèdent pas de vessie natatoire. Une autre caractéristique notable est qu’ils sont capables de détecter les champs électriques grâce a des organes appelés ampoules de Lorenzini (cf. Ampoules de Lorenzini) [29]. Le nombre de nerfs sensoriels de ces organes est comparable a celui d’un œil, d’une oreille, d’un nez ou d’une ligne latérale. Cette perception sensorielle permet au Elasmobranchii de détecter les champs électriques de leurs proies, de leurs congénères et leurs prédateurs. Dans le cadre de notre étude, nous nous restreindrons a l’exemple des requins.
Entrée sensorielle
[modifier | modifier le wikicode]Les champs électriques sont soit générés par une l’activité bioélectrique d’autres poissons ou par le mouvement de charge du champ magnétique terrestre.
Champs bioélectrique
[modifier | modifier le wikicode]Il existe trois types de champ électrique a proximité des poissons, définis par Kalmijn [30] :
- les champs continus allant jusqu’à 500 μV à proximité de la tête, des branchies et des plaies.
- les champs alternatifs (<20 Hz) allant jusqu’à 500 μV, essentiellement présents dans la tête et aux alentours des branchies, synchrones avec les mouvements respiratoires.
- les champs alternatifs à haute fréquence et faible intensité qui apparaissent lors de la contraction des muscles du tronc et de la queue du poisson.
Les champs alternatifs à basse fréquence sont causées par les fluctuations de la résistance des champs continus lors des mouvements respiratoires.
Des mesures sur 60 vertébrés différents montrent que des champs bioélectriques sont présents chez un grand nombre d’animaux. Les champs continus sont générés même sans activité musculaire et sont suffisants pour qu’un requin puisse les détecter lorsqu’il chasse une proie. Que ce soit une proie ou un congénère, le champ dipolaire qu’un requin perçoit peut être estimée par la formule suivante [31] :

Avec ε₀ le coefficient de perméabilité, p ⃗ le vecteur dipolaire, r ̂= r ⃗/|r ⃗| le vecteur unité de direction r ⃗ et |r ⃗| la distance à la source du dipôle.
Les requins peuvent détecter les phénomènes électriques en utilisant leurs électrorécepteurs de manière active (cf. Potentiel électrique induit) ou de manière passive [32]. Les requins peuvent détecter les champs dans leur environnement de manière passive tel que les champs bioélectriques de leurs proies ou les champs géoélectriques présents dans l’eau salée (cf 1.2. potentiel électrique induit. Une étude de Kalmijn montre les requins-citron se déplacent en ligne droite lorsqu’ils traversent de nord en sud la large baie de Bimini aux Bahamas. Il se peut que leur orientation se fasse grâce au champ électrique ambiant induit par les courants marins.
Potentiel électrique induit
[modifier | modifier le wikicode]À cause du champ magnétique terrestre, un flux d’eau salée ou le mouvement d’un requin peut induire un champ électrique continu [33](cf. Figure 8 et Figure 9). Une particule de charge q est sujette à une force de Lorentz F perpendiculaire au champs magnétique B, lorsque celle-ci se déplace à une vitesse v à travers le champ :
Des charges libres d’un élément sont déviées lors du mouvement de celui-ci à travers un champ magnétique selon l’équation ci-dessus. Cela créé une séparation des charges positives et négatives, ce qui mène à l’apparition d’un champ électrique induit.

Un litre d’eau salée contient environ 35g de sel dissous (principalement du Na+ et du Cl-) [34]. Les mouvements de l’eau tel que les courants marins entraînent donc un mouvement de charges électriques. Les charges positives et négatives sont déviées vers des directions opposées, ce qui mène à une séparation de charge. Le champ électrique ainsi induit est assez fort pour stimuler les électrorécepteurs des requins. Les fluides corporels des poissons contiennent beaucoup d’ions libres tels que Na+, K+, Ca2+, Cl- et HCO3-. De manière analogue aux courants marins, le mouvement du requin à travers le champ magnétique terrestre lui-même induit un champ électrique.
Quand un requin utilise ses électrorécepteurs de manière active, les champs électriques induits par lui-même par ses déplacements sont utilisés [32]. Caray et Scharold [35] ont observé que les requins bleus arrivent à garder un cap constant lors de leur migration à travers l’océan, et ce durant plusieurs jours. Une telle performance n’est possible que si l’on s’oriente en utilisant le champ magnétique terrestre. Les requins se servent du champ magnétique de manière active comme une boussole, tandis que le champ électrique ambiant est utilisé de manière passive pour s’orienter dans l’eau [36]. Ces deux modes d’opération forment un système d’orientation par électromagnétisme complémentaire.
Ampoules de Lorenzini
[modifier | modifier le wikicode]Anatomie
[modifier | modifier le wikicode]Les ampoules de Lorenzini, aussi appelées électrorécepteurs, sont des organes sensoriels qui détectent les champs électriques. Ces organes sont composés d’un systèmes de groupes de canaux remplies de gelée. Un côté du canal est formé de pores à la surface du derme ou de l’épiderme, qui apparaissent sous la forme de points noirs sur la peau du requin (cf. Figure 10) : Une tête de requin-tigre. Les petits points noirs sont les pores de ampoules de Lorenzini). L’autre côté du canal se termine sur une ampoule, un groupe de renflements tapissés par l'épithélium sensoriel (cf. Figure 11). Le nerf ampullaire est un groupe de nerfs afférents qui partent de chaque ampoule. Aucun nerf efférent ne rentre dans l’ampoule. Les groupes d’ampoules sont enfermés dans des capsules de tissu conjonctif étanche. La distribution de ces groupes varie d'une espèce à l'autre.

L’épithélium sensoriel est composé de cellules réceptrices en forme de poire, de cellules de support et d’une membrane basale (cf. Figure 12). Une cellule réceptrice n’est connectée au lumen de l’ampoule qu’en un seul point d’attache où se trouve le kinocilium. Les cellules de support comblent l’espace entre différentes cellules réceptrices. Les synapses en bout de nerf se trouvent à la base des cellules réceptrices. Cette base est connectée à la membrane basale. Les parois internes des canaux remplies de gelée sont composées d’un épithélium dont les cellules de la couche superficielle sont aplaties. Les cellules de la couche interne sont connectées les unes aux autres par des jonctions serrées, ce qui explique leur forte résistance. Les canaux, dont la gelée n’a qu’une faible résistance, servent ainsi de câbles basse fréquence [37]. Les requins ne sont donc sensible qu'aux gradients de champs continus et aux champs alternatifs faibles. Les parois externes sont composees de deux couches de fibres collagènes circulaires agencées et d’une couche de fibre collagène longitudinale.
Distribution autour de la tête
[modifier | modifier le wikicode]
Les pores qui forment l’entré des canaux remplis de gelée se situent principalement sur la surface dorsale et ventrale de la tête. Les canaux sont orientés dans différentes directions. Kim [38] a exploité les données de Dijkgraaf et Kalmijn [39] pour identifier 15 catégories d’ampoules chez le requin-taureau (cf. Figure 13). Quatorzes d’entre elles sont disposées symétriquement par paire de chaque côté. Une seule ampoule est située dorsalement sur l’axe de symétrie.
Transduction des stimuli
[modifier | modifier le wikicode]
Chez les raies, les électrorécepteurs ampullaires sont disposés de manière somatotopique [40], ce qui pourrait suggérer qu’il en est de même chez les requins. Différents neurones sont réglés afin de percevoir différentes orientations possibles du champ électrique. La courbe indiquant le taux de déclenchement en fonction de l’angle du champ électrique est en forme de cloche avec un seul maximum pour une direction spécifique. Ainsi, pour chaque neurone la stimulation maximale correspond principalement à une seule direction du champ.
Un seul canal doté d’une ampoule ne réagit qu’aux champs électriques d’une fréquence allant de 0,1 à 10 Hz [41] . Une proie immobile émet un champ électrique (cf. Champs bioélectrique) qui diminue rapidement en fonction de la distance. Si un requin s’approche de la proie, celui perçoit donc une variation de champ [42]. Cette variation de champ induit un courant dans les canaux remplis de gelée de l’ampoule de Lorenzini, ce qui change le potentiel électrique de l’ampoule [43]. La tension électrique est amplifiée dans l’ampoule grâce aux interactions entre les membranes apique et basale, via des canaux ioniques [44]. La membrane apique est le côté de la membrane qui entoure le lumen, tandis que la membrane basale forme une surface dirigée vers l’extérieur de la cellule. L’épithélium ampullaire peut être considéré comme un amplificateur linéaire d’une tension électrique inférieure à 100 μV. La tension est amplifiée par l’organe ampullaire en fonction de la formule ci-dessous [44] :
R_a, R_b et R_c sont les résistances de la membrane apique, de la membrane basale et des canaux. V_b et V_c sont les tensions électriques de la membrane basale et des organes ampullaires. Les canaux ioniques de la membrane apique ont une conductance qui dépend négativement de la tension, donc R_a < 0. Ainsi V_b > V_c et la tension de sortie est amplifiée. La tension de la membrane basilaire est nivelée au niveau de différents récepteurs et varie progressivement en fonction d’un stimulus physique adéquat, par exemple le champ bioélectrique d’une proie [45]. Le potentiel du récepteur est ainsi une représentation analogue du stimulus reçu.
Traitement du signal neuronal
[modifier | modifier le wikicode]Combinaison des sens électrique et olfactif
[modifier | modifier le wikicode]La plupart des champs électriques, générés par des proies ou des congénères, sont dipolaires (cf. Champ bioélectrique) [38]. Les lignes de champ électriques sont courbées et le dipôle source ne peut pas être prédit à partir du champ électrique local, qui est perceptible par les requins [38]. Même la distance à la source ne peut être estimée, car l’intensité du champ électrique n’est pas une mesure directe de la distance au dipôle source. Le champ électrique du dipôle se calcul en prenant l’inverse du cube de la distance à la différence de potentiel dans l’ampoule de Lorenzini. Le traitement de l’information du champ électrique et le mécanisme sensorimoteur, nécessaire la navigation vers les éléments, est, à ce jour, toujours inexplicable.
Vu que le champ électrique s’affaiblit rapidement au fur et à mesure de sa propagation, les requins ne peuvent détecter le champ des poissons proies que lorsqu’ils sont relativement proches [46]. Les signaux plus distants sont détectés par la pression de l’eau et l’odorat : par exemple les requins sont attirés par les champs olfactifs des poissons blessés sur de grandes distances. Les champs olfactifs sont facilement perturbables à cause des courants locaux et ne sont pas adaptés pour identifier l’emplacement exact d’un poisson blessé. Si un requin est assez proche, son sens électrique peut identifier de manière efficace l’emplacement de sa proie même lorsque celle-ci est enfouie sous le sable.

Kalmijn [47] a utilisé des électrodes pour imiter les champs bioélectriques des poissons proies. Les requins n’ont mordu que les électrodes, bien qu’il y ait eu une source d’odorat à proximité de l’électrode. L’électrode a déclenché l’appétit de grands aiguillats communs d’une distance allant de 40 cm jusqu’à 90 à 120 cm. A cette distance, les gradients électriques sont aux alentours de 5 nV/m. Les requins ont dû détecter le champ à une distance plus grande que celle où l’attaque a été déclenchée. Une attaque planifiée sur une longue distance n’est probablement pas la meilleure stratégie car les poissons proies peuvent facilement être alertés et ainsi facilement s’échapper. L’avantage majeur ne se situe pas au niveau de la distance d’attaque mais dans la puissance de pénétration du sens électrique qui permet aux requins de détecter les proies enfouies dans le sable.
Détection du champ électrique directionnel
[modifier | modifier le wikicode]Pour être capable de détecter les champs bioélectriques de leurs proies, les requins peuvent soustraire, par analogie avec les autres modes sensoriels, les signaux prévisibles produits par les champs de l’environnement ou les champs induits par le mouvement à travers le champ magnétique terrestre [37]. Pour étudier ce phénomène, nous pourrions effectuer une analyse de la distribution de potentiels instantanés à la surface de la peau, ou du changement de direction des champs en fonction du temps. À la distance où l’appétit est déclenché, le champ électrique est à peu près uniforme et peut à peine être distingué du bruit des récepteurs du système nerveux. L’algorithme d’attaque proposé par Kalmijn permettrait aux requins de détecter un dipôle produit par leur proie sans avoir à détecter leur position exacte : quand un requin perçoit pour la première fois un champ électrique d’une proie, celui-ci maintien un angle constant entre l’axe de son corps et la direction du champ local. Chaque déviation de cet angle est atténuée par une réaction négative. En suivant les lignes du champ électrique, le requin arrivera éventuellement à la source du dipôle. Cet algorithme est invariant à l’angle d’approche, à la polarité du champ, aux changements temporels de la force et de la direction du champ, et ainsi aux mouvement de leur proie.
À proximité du dipôle le champ devient plus compliqué et ainsi plus difficile à analyser. Les requins semblent pouvoir négliger complètement cela, étant donné qu’ils réussissent à mordre l’origine de la source du dipôle qui a été électriquement déplacée juste après l’initiation de l’attaque [47]. Des indicateurs additionnels sur le caractère non-uniforme du champ, tels que sa courbure ou le gradient de ses lignes de champ, pourraient signaler aux requins qu’ils doivent faire abstraction des propriétés du champ à un instant t. Cependant, dans le cas tridimensionnel, ou si le chemin de leur proie n’est pas contraint au plan contenant le dipôle, l’algorithme manque d’information, et ainsi produit un résultat approximatif.
Distinction entre mode passif et actif
[modifier | modifier le wikicode]La manière dont les requins distinguent les champs électriques ambiants (mode passif), et les champs induits par leurs déplacements à travers le champ magnétique terrestre (mode actif), est un mystère qui reste encore à élucider. Puisque les électrorécepteurs opèrent dans une gamme de fréquences de moins de 0,125 Hz à 8 Hz, Kalmijn [45] propose une démarche possible : les requins pourraient sonder leur orientation magnétique par une accélération momentanée, et examiner la direction d’un champ ambiant (d’une proie ou dû aux courants marins) par une rotation momentanée.
Inhibition controlatérale
[modifier | modifier le wikicode]Kim [38] a suggéré que chaque paire symétrique latérale de groupes d’ampoules (cf 2.1.1 Distribution autour de la tête) a une inhibition controlatérale pour localiser un dipôle source. Ceci peut être modélisé en prenant la différence d’intensité entre les groupes de paires. Le requin peut tourner la tête vers une direction de plus forte intensité pour localiser un dipôle source. La plus haute sensibilité de l’ampoule de Lorenzini se situe dans une gamme de fréquencse de 1-8 Hz et comprend la période habituelle des oscillations de la tête du requin. Le résultat des simulations menées par Kim montre qu’un élargissement de l’angle d’oscillation de la tête améliore l’estimation de la direction du champ électrique, car les mouvement de la tête permettent d’annuler les signaux bruités. Le signal est ainsi plus facile à distinguer du bruit. Cette découverte vient appuyer la thèse de Kalmijn [45] sur la stratégie de détection des champs électriques ambiants.
Références
[modifier | modifier le wikicode]- ↑ 1,0 1,1 1,2 et 1,3 Friedrich, R. W. (2013). Neuronal Computations in the Olfactory System of Zebrafish. The annual Review of Neuroscience.
- ↑ Braubach, O. R., (2012). Distribution and Functional Organization of Glomeruli in the Olfactory Bulbs of Zebrafish (Danio rerio). The Journal of Comparative Neurology.
- ↑ Figure 1 is adapted from: Friedrich, R. W., & Wiechert, M. T. (2014). Neuronal circuits and computations: Pattern decorrelation in the olfactory bulb. Elsevier.
- ↑ Fuller C. L., (2006). Mitral cells in the olfactory bulb of adult zebrafish (Danio rerio): morphology and distribution. J. Neurophysiology.
- ↑ Figure 2 is adapted from: Friedrich, R. W. (2013). Neuronal Computations in the Olfactory System of Zebrafish. The annual Review of Neuroscience.
- ↑ Friedrich, R. W., & Wiechert, M. T. (2014). Neuronal circuits and computations: Pattern decorrelation in the olfactory bulb. Elsevier.
- ↑ 7,0 et 7,1 Wiechert, M. T. et. al (2010). Mechanism of pattern decorrelation by recurrent neuronal circuits.
- ↑ Nachtigall, P.E. 1980, Odontocete echolocation performance on object size, shape and material, Pages 71-95 in Animal Sonar systems, ed. R. G. Busnel and J.F. Fish, New York: Plenum Press
- ↑ 9,0 et 9,1 A.D. Grinnell, Echolocation I: Behavior, In Encyclopedia of Neuroscience, edited by Larry R. Squire,, Academic Press, Oxford, 2009, Pages 791-800, ISBN 9780080450469
- ↑ Au, W. W. L. 1993, The Sonar of Dolphins, Springer-Verlag, New York
- ↑ 11,0 et 11,1 Richardson, W.J. Greene Jr, C.R., Malme, C.I., Thomson, D.H. 1995, Marine Mammals and Noise, Academic Press, San Diego
- ↑ Hooker, S. K., Toothed Whales, Overview, In Encyclopedia of Marine Mammals (Second Edition), edited by Perrin, W. F., Würsig, B. and Thewissen, J.G.M., Academic Press, London, 2009, Pages 1173-1179, ISBN 9780123735539
- ↑ Aroyan, J. L. 2001, Three-dimensional modeling of hearing in Delphinus delphis. J. Acoust. Soc. Am. 110, 3305-3318
- ↑ Au, W. W. and Fay, R. R 2000, Role of the Head and Melon, Pages 11-12 in Hearing by Whales and Dolphins, Springer-Verlag, New York
- ↑ Au, W. W. and Fay, R. R 2000, The Tympano-Periotic Complex, Pages 66-69 in Hearing by Whales and Dolphins, Springer-Verlag, New York
- ↑ Au, W. W. and Fay, R. R 2000, Cetacean Ears, Pages 43-108 in Hearing by Whales and Dolphins, Springer-Verlag, New York
- ↑ Au, W.W., Echolocation, in Encyclopedia of Marine Mammals (Second Edition), edited by Perrin, W.F., Würsig, B. and Thewissen, J.G.M. 2009, Academic Press, London, Pages 348-357, ISBN 9780123735539
- ↑ 18,0 et 18,1 Thomas, J. A. and Kastelein, R. A. 1990, Sensory Abilities of Cetaceans: Laboratory and Field Evidence, Page 196, Springer Science & Business Media, New York, ISBN 978-1-4899-0860-5
- ↑ Mass, A. M., Supin, A., Y. A. 2007, Adaptive features of aquatic mammals' eyes, Pages 701–715 in Anatomical Record. 290 (6) doi:10.1002/ar.20529
- ↑ Tinker, S.W. 1988, Whales of the World, Pages 81-86, Bess Pr Inc, Honolulu, ISBN 978-0-9358-4847-2
- ↑ Klinowska, M. 1990, Geomagnetic Orientation by Cetaceans, Pages 651-663 in Sensory Abilities of Cetaceans: Laboratory and Field Evidence, edited by Thomas, J. A. and Kastelein, R. A., Springer Science & Business Media, New York, ISBN 978-1-4899-0860-5
- ↑ S. Coombs, H. Bleckmann, R. R. Fay and A. N. Popper, The Lateral Line System, Springer Handbook of Auditory Research, 1992
- ↑ T. J. Pitcher, B. L. Partridge, and C. S. Wardl , A Blind Fish Can School, Science 194 p963-p965, 1976
- ↑ Å. Flock, Ultrastructure and function in the lateral line organs, In P. Cahn (ed.). Lateral Line Detectors; proceedings of a conference held at Yeshiva University, New York, Indiana University Press p163–p197, 1967
- ↑ E. G. Barham, W. B. Huckabay, R. Gowdy, and B. Burns, Microvolt Electric Signals from Fishes and the Environment, Science 164 p965-p968, 1969
- ↑ B. Budelmann, and H. Bleckmann, A lateral line analogue in cephalopods: Water waves generate microphonic potentials in the epidermal head lines of Sepia and Lolliguncula, Journal of comparative physiology. A, Sensory, neural, and behavioral physiology p164 1-5, 1988
- ↑ E. J. Denton and J. Gray, Lateral-line-like antennae of certain of the Penaeidea (Crustacea, Decapoda, Natantia), Proc. R. Soc. Lond. B.226249–261, 1985
- ↑ L. Miersch, W. Hanke, S. Wieskotten, F. D. Hanke, J. Oeffner, A. Leder, M. Brede, M. Witte and G. Dehnhardt, Flow sensing by pinniped whiskers, Phil. Trans. R. Soc. B3663077–3084, 2011
- ↑ Richard W. Murray, The Ampullae of Lorenzini, Chapter 4 in Handbook of Sensory Physiology Vol. 3, Springer Verlag Berlin, 1974
- ↑ Adrianus Kalmijn, Bioelectric fields in sea water and the function of the ampullae of Lorenzini in elasmobranch fishes, 1972
- ↑ Jackson J.D., Classical Electrodynamics, 3rd ed., John Wiley and Sons, New York, 1999
- ↑ 32,0 et 32,1 Adrianus Kalmijn, The Detection of Electric Fields from Inanimate and Animate Sources Other Than Electric Organs, Chapter 5 in Handbook of Sensory Physiology Vol. 3, Springer Verlag Berlin, 1974
- ↑ Michael Paulin, Electroreception and the Compass Sense of Sharks, 1995
- ↑ http://en.wikipedia.org/wiki/Seawater, 11.08.2014
- ↑ E. G. Carey and J.V. Scharold, Movements of blue sharks (Prionace glauca) in depth and course, 1990
- ↑ Adrianus Kalmijn, Appendix in E. G. Carey and J.V. Scharold, Movements of blue sharks (Prionace glauca) in depth and course, 1990
- ↑ 37,0 et 37,1 Adrianus Kalmijn, Detection of Weak Electric Fields, Chapter 6 in Sensory Biology of Aquatic Animals, Springer-Verlag New York Inc., 1988
- ↑ 38,0 38,1 38,2 et 38,3 DaeEun Kim, Prey detection mechanism of elasmobranchs, 2007
- ↑ S. Dijkglcaaf and A. J. Kalmijn, Untersuchungen über die Funktion Der Lorenzinischen Ampullen an Haifischen, 1963
- ↑ Jeff Schweitzer, Functional organization of the electroreceptive midbrain in an elasmobranch (Platyrhinoidis triseriata), 1985
- ↑ R. W. Murray, The Response of the Ampullae of Lorenzini of Elasmobranchs to Electrical Stimulation, 1962
- ↑ Brandon R. Brown, Modeling an electrosensory landscape: behavioral and orphological optimization in elasmobranch prey capture, 2002
- ↑ R. Douglas Fields, The shark’s electric sense, 2007
- ↑ 44,0 et 44,1 Jin Lu and Harvey M. Fishman, Interaction of Apical and Basal Membrane Ion Channels Underlies Electroreception in Ampullary Epithelia of Skates, 1994
- ↑ 45,0 45,1 et 45,2 Adrianus Kalmijn, Detection and processing of electromagnetic and near field acoustic signals in elasmobranch fishes, 2000
- ↑ Adrianus Kalmijn, The Electric Sense of Sharks and Rays, 1971
- ↑ 47,0 et 47,1 Adrianus J. Kalmijn and Matthew B. Weinger, An Electrical Simulator of Moving Prey for the Study of Feeding Strategies in Sharks, Skates, and Rays, 1981




