Systèmes sensoriels/Implants Neurosensoriels
Introduction
Système auditif
Système vestibulaire
Système somatosensoriel
Système olfactif
Système gustatif
Implants rétiniens[modifier | modifier le wikicode]
Depuis la fin du XXe siècle, de nombreux groupes de recherche et certaines sociétés privées du monde entier ont pour objectif de restaurer la vue des personnes aveugles au moyen de prothèses artificielles. Semblable aux implants cochléaires, le concept clé consiste à stimuler le système nerveux visuel avec des pulses électriques, en contournant les photorécepteurs endommagés ou dégénérés de la rétine humaine. Dans ce chapitre, nous décrirons les fonctionnalités de base d'un implant rétinien, ainsi que les différentes approches en cours d'étude et de développement. Les deux approches les plus courantes des implants rétiniens sont appelées implants «épi-rétiniens» et «sous-rétiniens», correspondant aux prothèses oculaires situées respectivement au-dessus ou en-dessous de la rétine. Nous ne couvrirons pas les approches non liées à la rétine pour restaurer la vision, telles que le système de vision BrainPort qui vise à stimuler la langue à partir de données visuelles, des électrodes de manchette autour du nerf optique ou des implants de stimulation dans le cortex visuel primaire.
Structure rétinienne et fonctionnalité[modifier | modifier le wikicode]
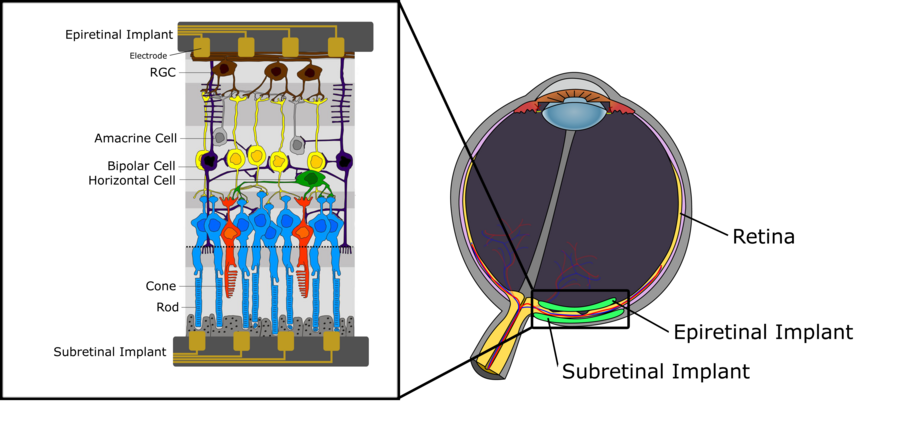
La figure 1 décrit la structure nerveuse schématique de la rétine humaine. Nous pouvons différencier trois couches de cellules. La première, située la plus éloignée du cristallin, est constituée des photorécepteurs (bâtonnets et cônes) destinés à la transduction de la lumière entrante en signaux électriques qui sont ensuite propagés à la couche intermédiaire, principalement composée de cellules bipolaires. Ces cellules bipolaires, connectées à des photorécepteurs et à des types de cellules telles que les cellules horizontales et les cellules amacrines, transmettent le signal électrique aux cellules ganglionnaires de la rétine (CGR). Pour une description détaillée de la fonctionnalité des cellules bipolaires, en particulier en ce qui concerne leur subdivision en cellules bipolaires ON et OFF, cf. le chapitre Systèmes visuels. La couche supérieure, composée de CGR, collecte les pulses électriques des cellules horizontales et les transmet au thalamus via le nerf optique. De là, les signaux sont propagés au cortex visuel primaire. Il convient de mentionner certains aspects essentiels concernant le traitement du signal dans la rétine humaine. D'abord, alors que les cellules bipolaires, ainsi que les cellules horizontales et amacrines, génèrent des potentiels gradués, les CGR génèrent des potentiels d'action. De plus, la densité de chaque type de cellule n'est pas uniforme à travers la rétine. Bien qu’il y ait une densité extrêmement élevée de bâtonnets et de cônes dans la région de la fovéa, avec en outre très peu de photorécepteurs connectés aux CGR via la couche intermédiaire, on trouve une densité beaucoup plus faible de photorécepteurs dans les régions périphériques de la rétine photorécepteurs connectés respectivement à une seule CGR. Cette plus faible densité de photodétecteurs a également des implications directes sur le champ récepteur d'une CGR. En effet, les champs récepteurs ont tendance à grandir rapidement vers les régions périphériques de la rétine, simplement en raison de la densité de photorécepteur plus faible et du nombre accru de photorécepteurs connectés à une même CGR.
Cas d'utilisation d'un implant: Maladies dégénératives rétiniennes[modifier | modifier le wikicode]
Comme mentionné précédemment dans ce wiki, la rétine est un tissu sensible à la lumière situé à l'arrière de l'œil et constitué de différentes couches qui contiennent une variété de types de cellules. La rétine est principalement impliquée dans le traitement visuel neuronal avec des signaux provenant de photorécepteurs et se rendant au cerveau par les axones des cellules ganglionnaires. Lorsque ce tissu stratifié dégénère, une perte de vision permanente peut survenir [1]. Ceci est souvent causé par des maladies dégénératives de la rétine telles que la dégénérescence maculaire liée à l'âge (DMLA) et la rétinite pigmentaire (RP), qui sont les deux affections les plus courantes conduisant progressivement à des déficiences et pertes visuelles permanentes. À l’heure actuelle, il n’existe aucun traitement pour ces deux maladies de la rétine et, les thérapies modernes n'ayant que la capacité de ralentir la progression de la maladie, des stratégies sont nécessaires pour restaurer la vision des patients. L'un des outils actuellement à l'étude est la technologie de la prothèse rétinienne, qui stimule le rétablissement de la vision par un tissu rétinien viable, qui sera décrite dans une section ultérieure [2].
Dégénérescence maculaire liée à l'âge (DMLA)[modifier | modifier le wikicode]
Comme son nom l'indique, la dégénérescence maculaire est une maladie dégénérative de la rétine dont l'apparition se manifeste principalement chez les personnes âgées. La DMLA s'articule autour de la dégénérescence progressive des photorécepteurs à cônes dans la macula, conduisant à une vision floue au centre du champ visuel. Cela peut progresser jusqu'à un point où l'individu a une perte de vision complète au centre du champ visuel, appelée tache aveugle. Bien que la DMLA puisse toucher l’un ou les deux yeux, elle conduit rarement à une cécité complète, car la vision périphérique du patient reste intacte. Il existe deux principaux types de DMLA: sèche et humide. La DMLA sèche représente la majorité des cas de la maladie et se caractérise par de petits dépôts jaunes, appelés drusen, se produisant dans la macula entre l'épithélium pigmentaire rétinien et la choroïde. Au début, la progression de cette forme de DMLA est lente avec très peu de symptômes et ne s’intensifie que lorsque l’atrophie rétinienne se produit. La forme humide de la DMLA se caractérise par une néovascularisation dans la choroïde, c'est-à-dire une croissance anormale des vaisseaux sanguins susceptibles de se rompre et d'entraîner des fuites sanguines, une fuite de protéines et des cicatrices, entraînant des lésions irréversibles des cônes et donc une perte de vision. La progression de la forme humide et la perte de vision sont beaucoup plus rapides que pour la DMLA sèche [3].
Rétinite pigmentaire (RP)[modifier | modifier le wikicode]

La rétinite pigmentaire est une maladie oculaire dégénérative héréditaire impliquant les bâtonnets et qui apparaît tôt chez les jeunes. Dû à cette maladie, les bâtonnets se détériorent progressivement et mènent finalement à une perte de vision dans le champ de vision périphérique ainsi qu’à une perte de la vision nocturne. Cette perte se produit d'abord à l'extérieur, puis progresse vers l'intérieur, créant un effet de «vision tunnel» chez le patient. La déficience visuelle se produit de manière symétrique, les deux yeux étant atteints dans des délais similaires. Contrairement à la DMLA, cette maladie oculaire peut s'étendre au-delà de la périphérie et commencer à affecter le champ visuel central par la dégénérescence des cellules photoréceptrices coniques. Cela laisse la personne avec une perte de vision continue qui peut éventuellement conduire à une cécité complète, bien que ce soit assez rare. La rétinite pigmentaire est génétiquement héritée et présente une variété de mutations génétiques pouvant conduire à un phénotype de RP, conduisant à une variété de modèles d'héritage. Toutefois, lorsque le mode de transmission est autosomique dominant, la majorité des cas est liée à des mutations du gène de la rhodopsine. Cette mutation perturbe le fonctionnement de la rhodopsine, qui est une protéine essentielle du cycle de la vision. Il n'existe actuellement aucun traitement curatif pour la rétinite pigmentaire [2]. Cependant, en 2008, Shigeru Sato et ses collègues ont découvert une protéine rétinale de type «matrice extracellulaire» appelée pikachurine, qui pourrait conduire à un traitement de la maladie en raison de son implication dans les interactions entre les cellules photoréceptrices et les cellules bipolaires [4].
Réseaux de microélectrodes pour la stimulation de la rétine[modifier | modifier le wikicode]

Tel que susmentionné, il n’existe aucun traitement pour les déficiences visuelles progressives causées par la dégénérescence maculaire et la rétinite pigmentaire. Cependant, dans les deux maladies, malgré une importante perte de cellules photoréceptrices, une quantité importante de neurones de la rétine interne survit des années après le début de la maladie. Ceci fournit une opportunité pour une stimulation artificielle des cellules rétiniennes restantes fonctionnant encore correctement, au moyen d’électrodes, afin de restaurer les informations visuelles du patient humain. Des réseaux de microélectrodes utilisent des électrodes pour stimuler la rétine de manière extracellulaire. Par un placement serré, permettant de former une interface électrochimique entre le réseau et la solution saline trouvée autour de la rétine, le courant passe à travers l’interface matrice-rétine. Finalement, ceci entraîne la dépolarisation des membranes des neurones qui produisent alors des potentiels d’action. Cette stimulation peut être cathodique ou anodique. Lors de la stimulation cathodique, des charges négatives apparaissent à l'extérieur de la membrane, entraînant ainsi des charges positives intracellulaires, ce qui résulte dans un gradient de dépolarisation le plus fort à proximité de l'électrode. Dans la stimulation anodique, l'hyperpolarisation se produit dans les zones les plus proches des électrodes et la dépolarisation se produit à des distances plus grandes. Par conséquent, la stimulation cathodique est généralement considérée comme plus efficace, car elle nécessite une des courants beaucoup plus faibles. La phase de stimulation n'est pas le seul facteur qui affecte l'efficacité de la stimulation. La forme d'onde, qui peut prendre diverses formes, telles que monophasiques et biphasiques, joue un rôle important dans la sécurité de la stimulation des neurones rétiniens. Par exemple, chez les singes, il a été constaté qu'un courant monophasique ne comportant qu'une phase anodique pouvait endommager des cellules auparavant viables. Par conséquent, les implants qui utilisent la stimulation rétinienne utilisent une forme d'onde biphasique à charges équilibrées. Cette forme d'onde utilise une phase cathodique pour la stimulation et une phase anodique pour la décharge, équilibrant ainsi les charges autour de la membrane. Une prothèse rétinienne de stimulation peut être implantée derrière la rétine, et est alors désignée «implant sous-rétinien». Cette forme d’implant rapproche les électrodes des photorécepteurs endommagés et des cellules bipolaires qui fonctionnent encore correctement, constituant la véritable cible de stimulation. Si les électrodes de stimulation pénètrent dans la choroïde, qui contient l'apport sanguin de la rétine, les implants sont parfois appelés implants "suprachoroïdiens". En outre, un implant peut être placé sur la rétine, au plus près de la couche de cellules ganglionnaires, dans le but de stimuler les cellules de rétention ganglionnaire. Ces implants sont appelés implants épi-rétiniens. Les deux approches sont actuellement étudiées par plusieurs groupes de recherche. Ils présentent tous les deux des avantages et des inconvénients importants. Avant de les traiter plus en détail séparément, nous décrivons certains des principaux problèmes à prendre en compte dans les deux cas [2].
Défis[modifier | modifier le wikicode]
Défis technologiques liés aux électrodes[modifier | modifier le wikicode]
Un grand défi pour les implants rétiniens provient de la densité spatiale extrêmement élevée des cellules nerveuses dans la rétine humaine. Il y a environ 125 millions de photorécepteurs (bâtonnets et cônes) et 1,5 million de cellules ganglionnaires dans la rétine humaine, à l’opposé de seulement environ 15 000 cellules ciliées dans la cochlée humaine [5] [6]. Dans la fovéa, où l’acuité visuelle est la plus élevée, jusqu’à 150’000 cônes sont situés sur un millimètre carré. Bien qu'au total il y ait beaucoup moins de CGR par rapport aux photorécepteurs, leur densité dans la zone fovéale est proche de celle des cônes, ce qui représente un défi considérable pour le traitement des cellules nerveuses avec une résolution spatiale suffisamment élevée au moyen d’électrodes artificielles. Pratiquement toutes les expériences scientifiques actuelles sur les implants rétiniens utilisent des matrices de micro-électrodes (MEA: multi-electrode array) pour stimuler les cellules de la rétine. Les MEA à haute résolution atteignent un espacement inter-électrodes d'environ 50 micromètres, ce qui donne une densité d'électrodes de 400 électrodes par millimètre carré. Par conséquent, une association 1:1 entre électrodes et photorécepteurs ou CGR est impossible dans la zone fovéale avec les technologies conventionnelles pour électrodes. Cependant, la densité spatiale des photorécepteurs ainsi que celle des CGR diminuent rapidement vers les régions externes de la rétine, ce qui facilite la stimulation individuelle entre électrodes et cellules nerveuses périphériques [7]. Un autre défi consiste à faire fonctionner les électrodes dans des limites de sécurité. Imposer des densités de charge supérieures à 0,1 mC/cm² peut endommager le tissu nerveux [7]. Généralement, plus une cellule est éloignée de l'électrode de stimulation, plus l'amplitude du courant nécessaire à la stimulation de la cellule est grande. En outre, plus le seuil de stimulation est bas, plus l'électrode peut être conçue petite et plus les électrodes peuvent être placées de manière compacte sur les MEA, améliorant ainsi la résolution de stimulation spatiale. Le seuil de stimulation est défini comme la puissance de stimulation minimale nécessaire pour déclencher une réponse nerveuse dans au moins 50% des pulses de stimulation. Pour ces raisons, l’un des principaux objectifs de la conception d’implants rétiniens est d’utiliser un courant de stimulation aussi faible que possible tout en garantissant une stimulation fiable (c’est-à-dire la génération d’un potentiel d’action dans le cas des cellules CGR) de la cellule cible. Ceci peut être réalisé en plaçant l'électrode aussi près que possible de la cellule cible qui réagit le plus à un pulse de champ électrique appliqué. Une autre possibilité pour achever ceci consiste à faire pousser les projections des cellules, telles que les dendrites et / ou les axones, sur l'électrode, ce qui permet une stimulation de la cellule avec des courants très faibles et bien que le corps de la cellule soit situé loin. En outre, un implant fixé à la rétine suit automatiquement les mouvements du globe oculaire. Bien que cela comporte des avantages importants, cela signifie également que toute connexion à l'implant - pour ajuster les paramètres, lire les données ou fournir une alimentation externe pour la stimulation - nécessite un câble qui se déplace avec l'implant. Lorsque nous bougeons les yeux environ trois fois par seconde, le câble est exposé et les connexions sont soumises à de fortes contraintes mécaniques. Pour un appareil qui doit fonctionner pendant toute une vie sans intervention extérieure, ceci pose un défi de taille aux matériaux et aux technologies concernés.
Défis de biocompatibilité[modifier | modifier le wikicode]
Outre les problèmes électriques, le contact avec les tissus biologiques constitue un défi majeur pour un implant rétinien. En effet, une réponse immunitaire est déclenchée lorsqu'une substance étrangère, telle qu'un implant, entre en contact avec des substances physiologiques. Cette réponse prend généralement la forme d'une inflammation ou d'un isolement de la substance, ce qui conduit souvent à la formation de cicatrices dans les tissus impliqués. Ceci est un problème en particulier avec les implants rétiniens car la prothèse doit être insérée, à l'emplacement approprié à travers les tissus. Si le matériel utilisé est trop tranchant ou n'est pas placé avec précaution, le tissu peut se blesser et intensifier davantage la réponse immunitaire. De plus, ces réponses peuvent entraîner une perte de signal électrique au fil du temps, car le système immunitaire peut «encapsuler» la zone stimulée au fil du temps, ce qui complique la tâche d'un implant de longue durée. Jusqu'à présent, un implant épirétinien, Argus II, a pu contourner les problèmes de biocompatibilité et fonctionnait encore après 3 ans dans un patient. Cet implant utilise du silicone, un matériau qui présente une bonne biocompatibilité à long terme, et constitue un substrat rigide qui permet de facilement maintenir la configuration de l’appareil. D'autres matériaux tels que le polyimide et l'or ont été étudiés pour la fonctionnalité et la biocompatibilité des implants rétiniens. Le polyimide est un polymère prometteur pour les futurs implants, car les implants fabriqués à partir de ce matériau ont été fonctionnels pour des yeux humains lors d'études de courte durée. Un tel matériau est avantageux en raison de sa biocompatibilité élevée, de sa flexibilité et de ses faibles coûts. L'optimisation des matériaux adaptés aux implants rétiniens est en plein cours, car les avancées technologiques produisent des réseaux de microélectrodes plus complexes nécessitant différents substrats pour une fonctionnalité maximale [8] [9].
Implants sous-rétiniens[modifier | modifier le wikicode]
Comme le nom le suggère, les implants sous-rétiniens sont des prothèses visuelles situées derrière la rétine. Par conséquent, l'implant est situé le plus près possible des photorécepteurs endommagés, dans le but de contourner les tiges et les cônes et de stimuler les cellules bipolaires dans la couche nerveuse suivante de la rétine. Le principal avantage de cette approche réside dans le fait que le traitement du signal visuel qui se produit entre les photorécepteurs et les cellules bipolaires et qui doit être imité par l’implant est relativement faible. C'est-à-dire que des informations visuelles brutes, par exemple capturées par une caméra vidéo, peuvent être transmises directement au MEA, ou avec un traitement relativement rudimentaire du signal, peuvent stimuler les cellules bipolaires, ce qui simplifie la procédure du point de vue du traitement du signal. Cependant, cette approche présente de graves inconvénients. La résolution spatiale élevée des photorécepteurs dans la rétine humaine pose un défi majeur au développement et à la conception d'un MEA avec une résolution de stimulation suffisamment élevée et, par conséquent, avec un faible espacement entre les électrodes. De plus, l'empilement des couches nerveuses dans la direction z (avec le plan x-y tangent à la courbure de la rétine) ajoute une autre difficulté lorsqu'il s'agit de placer les électrodes à proximité des cellules bipolaires. Avec le MAE situé derrière la rétine, il y a un écart spatial important à combler entre les électrodes et les cellules cibles. Comme mentionné ci-dessus, une distance accrue entre les électrodes et les cellules cibles oblige le MAE à fonctionner avec des courants plus élevés, augmentant la taille des électrodes, le nombre de cellules dans la plage de stimulation d'une seule électrode ainsi que la séparation spatiale entre les électrodes adjacentes. Tout cela aboutit à une diminution de la résolution de stimulation et soumet la rétine à un risque de lésion tissulaire provoqué par des densités de charge trop élevées. Comme indiqué ci-dessous, un moyen de surmonter les grandes distances entre les électrodes et les cellules cibles consiste à faire pousser les projections des cellules sur des distances plus longues et directement sur l'électrode.
En 2010, un groupe de recherche allemand, en collaboration avec la société privée allemande «Retina Implant AG», a publié les résultats d'études impliquant des tests sur implants sous-rétiniens chez l'homme [10] . Un réseau de microphotodiodes de trois sur trois millimètres (MPDA: microphotodiode array) contenant 1 500 pixels, chaque pixel étant constitué d'une photodiodes individuelles à détection de lumière et d'une électrode, a été implanté derrière la rétine de trois patients atteints de cécité due à une dégénérescence maculaire. Les pixels étaient situés à environ 70 micromètres les uns des autres, produisant une résolution spatiale d’environ 160 électrodes par millimètre carré - ou, comme indiqué par les auteurs du document, un angle de cône visuel de 15 arcmin pour chaque électrode. Il convient de noter que, contrairement aux implants utilisant des caméras vidéo externes pour générer une entrée visuelle, chaque pixel du MPDA contient lui-même une photodiode sensible à la lumière, générant de manière autonome le courant électrique à partir de la lumière reçue par le globe oculaire pour sa propre électrode associée. Ainsi, chaque pixel MPDA correspond, dans toute sa fonctionnalité, à une cellule photoréceptrice. Cela présente un avantage majeur: le MPDA étant fixé derrière la rétine humaine, il suit automatiquement les mouvements du le globe oculaire. Et puisque le MPDA reçoit lui-même l’entrée visuelle pour générer les courants électriques pour les électrodes de stimulation, les mouvements de la tête ou du globe oculaire sont gérés naturellement et ne nécessitent aucun traitement artificiel. Chez l'un des patients, le MPDA était placé directement sous la macula, ce qui donnait des résultats supérieurs aux tests expérimentaux par rapport aux deux autres patients, dont le MPDA était implanté plus loin du centre de la rétine. Les résultats obtenus par le patient avec l'implant derrière la macula étaient extraordinaires. Il était capable de reconnaître des lettres (5 à 8 cm de large) et de lire des mots, ainsi que de distinguer des motifs noir-blanc avec des orientations différentes [10].
Les résultats expérimentaux avec les implants MPDA ont également attiré l'attention sur un autre phénomène visuel, révélant un avantage supplémentaire de l'approche utilisant des MPDA par rapport aux implants utilisant des dispositifs d'imagerie externes: une stimulation ultérieure des cellules rétiniennes entraîne rapidement une diminution des réponses, ce qui suggère que les neurones rétiniens sont inhibés après avoir été stimulés à plusieurs reprises pendant une brève période. Cela implique qu'une entrée visuelle projetée sur un MEA fixé sur ou derrière la rétine produira une image détectée qui s'estompe rapidement, même si la stimulation électrique des électrodes reste constante. Cela est dû au fait que les électrodes fixées sur la rétine stimulent constamment les mêmes cellules sur la rétine, ce qui les rend de moins en moins sensibles à un stimulus constant dans le temps. Cependant, le processus est réversible et les cellules retrouvent leur sensibilité initiale une fois le stimulus absent. Alors, comment un système visionnaire intact gère-t-il cet effet ? Pourquoi des humains en bonne santé sont-ils capables de réparer un objet sans qu’il disparaisse au fur et à mesure ? Comme mentionné dans [11], l’œil humain s'adapte en permanence à de petits mouvements imperceptibles des yeux, ce qui permet de projeter le même stimulus visuel sur des points rétiniens légèrement différents au fil du temps, même si nous avons tendance à nous concentrer et à fixer l'œil sur un objet cible. Ceci contourne avec succès l’atténuation de la réponse cellulaire décrite auparavant. Avec l'implant servant à la fois de photorécepteur et de stimulateur d'électrodes, comme c'est le cas avec les MPDA, les petits ajustements oculaires naturels peuvent facilement être utilisés pour profiter de cet effet. D’autres approches implantaires utilisant une entrée visuelle externe (c’est-à-dire des caméras vidéo) souffrent de l’atténuation progressive de leur image perçue si elles sont stimulées en permanence. Le scintillement rapide et artificiel des images de la caméra peut ne pas résoudre le problème car ce mouvement externe peut ne pas être conforme au mouvement de l'œil et, par conséquent, le cortex visuel peut l'interpréter simplement comme une scène ondulée ou floue au lieu de la projection stable à long terme souhaitée de l'image fixe. Un autre avantage des implants sous-rétiniens est la corrélation précise entre les zones stimulées sur la rétine et la localisation perçue du stimulus dans le champ visuel du sujet humain. Contrairement aux CGR, dont l'emplacement sur la rétine peut ne pas correspondre directement à l'emplacement de leurs champs récepteurs individuels, la stimulation d'une cellule bipolaire est perçue exactement à l’endroit du champ visuel qui correspond à l'emplacement géométrique sur la rétine où la cellule bipolaire réside. Un inconvénient évident des implants sous-rétiniens est la procédure chirurgicale invasive impliquée.
Implants épirétinaux[modifier | modifier le wikicode]
Les implants épirétiniens sont situés au-dessus de la rétine et donc les plus proches des cellules ganglionnaires de la rétine (CGR). Pour cette raison, les implants épirétiniens ont pour objectif de stimuler directement les CGR, contournant non seulement les photorécepteurs endommagés, mais également tout traitement visuel neural intermédiaire par les cellules bipolaires, horizontales et amacrines. Cela présente certains avantages: Tout d'abord, la procédure chirurgicale pour un implant épirétinien est beaucoup moins critique que pour un implant sous-rétinien, car la prothèse n'a pas besoin d'être implantée au derrière de l'œil. De plus, il y a beaucoup moins de CGR que de photorécepteurs ou de cellules bipolaires, ce qui permet une stimulation plus fine avec une distance accrue entre les électrodes (au moins dans les régions périphériques de la rétine), ou une densité d'électrode même supérieure à celle de la densité réelle de CGR, permettant plus de flexibilité et de précision lors de la stimulation des cellules. Une étude sur la stimulation épirétinienne de cellules en parasol périphériques réalisée sur des rétines de macaques fournit des détails quantitatifs [7]. Les cellules en parasol sont un type de CGR constituant la deuxième voie visuelle la plus dense de la rétine. Leur objectif principal est de coder le mouvement des objets dans le champ visuel, détectant ainsi le mouvement. Les expériences ont été réalisées in vitro en plaçant le tissu rétinien de macaque sur un MEA à 61 électrodes (espacement inter-électrodes de 60 micromètres). 25 cellules en parasol individuelles ont été identifiées et stimulées électriquement, tandis que des propriétés telles que le seuil de stimulation et le meilleur emplacement pour stimulations ont été analysées. Le courant de seuil a été défini comme étant le courant le plus bas ayant déclenché un pic sur la cellule cible pour 50% des pulses de stimulation (durée de chaque pulse: 50 millisecondes). Deux aspects notables sont: premièrement, les cellules en parasol présentent un comportement de potentiel d’action, par opposition aux cellules bipolaires qui fonctionnent avec des potentiels gradués. Deuxièmement, les électrodes sur le MAE étaient utilisées à la fois pour les pulses de stimulation et pour enregistrer la réponse de stimulation des cellules cibles. 25 cellules en parasol ont été placées sur le MAE à 61 électrodes avec une densité d'électrodes significativement supérieure à la densité de cellules en parasol, revenant à avoir multiples électrodes dans les champs récepteurs d'une seule cellule en parasol. En plus de mesurer les seuils de stimulation nécessaires pour déclencher une réponse cellulaire fiable, la localisation de la meilleure stimulation a également été déterminée. L'emplacement de la meilleure stimulation fait référence à l'emplacement de l'électrode de stimulation par rapport à la cellule cible où le seuil de stimulation le plus bas a été atteint. Étonnamment, il a été découvert que ceci ne se trouvait pas sur le péricaryon de la cellule, comme on pouvait s'y attendre, mais environ 13 micromètres plus loin dans l'axe des axones. À partir de cette découverte, les expériences ont montré l'augmentation quadratique prévue des courants de seuil de stimulation par rapport à l'augmentation de la distance entre électrodes et péricaryon. Les résultats de l'étude ont également montré que tous les seuils de stimulation étaient bien inférieurs aux limites de sécurité (environ 0,05 mC / cm², alors que 0,1 mC / cm² était une limite de sécurité (basse)) et que la réponse cellulaire à un pulse de stimulation était rapide (0,2 ms latence en moyenne) et précise (faible variance sur la latence). En outre, la densité d'électrodes supérieure à la densité de cellules en parasol a permis un adressage fiable de cellules individuelles par la stimulation des électrodes appropriées, tout en empêchant les cellules voisines d’également produire un pic.
Aperçu général des approches techniques alternatives[modifier | modifier le wikicode]
Dans cette section, nous donnons un bref aperçu de certaines approches et technologies alternatives en cours de recherche.
Electrodes basées sur les nanotubes[modifier | modifier le wikicode]
Les MAE classiques contiennent des électrodes en nitrure de titane ou en oxyde d’indium et d’étain, exposant l’implant à de graves problèmes de biocompatibilité à long terme [12]. Une alternative prometteuse aux électrodes métalliques sont les nanotubes de carbone (CNT: carbon nanotubes) qui combinent plusieurs propriétés très avantageuses. Premièrement, ils sont entièrement biocompatibles car ils sont fabriqués à partir de carbone pur. Deuxièmement, leur robustesse les rend aptes à une implantation à long terme, une propriété essentielle des prothèses visuelles. En outre, la bonne conductivité électrique leur permet de fonctionner comme des électrodes. Enfin, leur nature très poreuse conduit à des surfaces de contact extrêmement grandes, ce qui encourage les neurones à se développer par-dessus les CNT, améliorant ainsi le contact neurone-électrode et réduisant les courants de stimulation nécessaires pour déclencher une réponse cellulaire. Cependant, les électrodes de CNT ne sont apparues que récemment et pour l'instant, peu de résultats scientifiques sont disponibles.
Approches des implants sans fil[modifier | modifier le wikicode]
L'un des principaux défis techniques de l'implant rétinien concerne le câblage qui relie le MEA aux stimuli externes, à l'alimentation et aux signaux de contrôle. La contrainte mécanique exercée sur le câblage affecte sa stabilité et sa durabilité à long terme, ce qui impose un grand défi aux matériaux utilisés. Les technologies sans fil pourraient être un moyen de contourner tout câblage entre l’implant rétinien et les dispositifs externes. L'énergie de la lumière entrante à travers l'œil n'est pas suffisante pour déclencher des réponses neuronales. Par conséquent, pour faire fonctionner un implant sans fil, de la puissance supplémentaire doit être fournie à l’implant. Une approche présentée par la Stanford School of Medecine utilise un écran LCD infrarouge pour projeter la scène capturée par une caméra vidéo sur des lunettes de protection, en réfléchissant les pulses infrarouges sur la puce située sur la rétine. La puce utilise également une batterie rechargeable photovoltaïque pour fournir l’énergie nécessaire au transfert de la lumière infrarouge en pulses de stimulation suffisamment forts. Semblable à l’approche sous-rétinienne, ceci permet également à l’œil de se fixer et de se concentrer naturellement sur les objets de la scène, car il peut bouger librement, ce qui permet de projeter différentes parties de l’image infrarouge des lunettes sur les différentes zones de la puce sur la rétine. Au lieu d'utiliser la lumière infrarouge, des bobines inductives peuvent également être utilisées pour transmettre de l'énergie et des signaux de données provenant de dispositifs externes à l'implant sur la rétine. Cette technologie a été implémentée et testée avec succès dans l'implant rétinien EPIRET3 [13]. Cependant, ces tests étaient davantage une démonstration de faisabilité, car seule la capacité du patient à détecter un signal visuel lors de l’application d’un stimulus sur les électrodes était testée.
Croissance neuronale dirigée[modifier | modifier le wikicode]
Une façon de permettre une stimulation neuronale très précise avec des courants extrêmement faibles et même sur de plus longues distances consiste à faire en sorte que les neurones développent leurs projections sur l'électrode. En appliquant une solution chimique adéquate sur le tissu rétinien, la croissance neuronale peut être encouragée. Ceci peut être réalisé en appliquant une couche de laminine sur la surface de la MEA. Afin de contrôler les chemins neuronaux, la laminine n'est pas appliquée uniformément sur la surface de la MEA, mais dans des pistes étroites formant un motif correspondant aux connexions, ce qui doit permettre aux neurones de se former. Ce processus d’application de la laminine d’une manière précise et en motif est appelé «impression par microcontact». La figure 5 présente une image de ce à quoi ressemblent ces motifs de laminine. La croissance neuronale dirigée obtenue avec succès avec cette méthode a permis d'appliquer des courants de stimulation nettement inférieurs à la stimulation par électrode classique, tout en permettant de déclencher de manière fiable la réponse neurale [14]. De plus, le seuil de stimulation ne suit plus l'augmentation quadratique par rapport à la distance électrode-péricaryon, mais reste constant au même niveau bas, même pour des distances plus longues (> 200 micromètres).
Réseaux de microélectrodes pour la caractérisation de la fonction rétinienne: une technologie basée sur CMOS[modifier | modifier le wikicode]
Comme expliqué précédemment dans la section portant sur les défis des implants rétiniens, de nombreux réseaux de microélectrodes souffrent des larges distances inter-électrodes et d'un petit nombre d'électrodes, ce qui affecte leur spécificité et le ciblage des neurones dans les réseaux de neurones. Ceci est un facteur limitant pour pouvoir reconnaître la dynamique de réseau et les fonctionnalités des populations neuronales. Plus précisément, de nombreux détails cellulaires tels que les vitesses de propagation axonale et le traitement de l'information axonale sont perdus dans les porte-électrodes de densité inférieure. Récemment, les chercheurs ont tiré parti de la technologie CMOS (complementary metal oxide semiconductor) pour créer des réseaux de microélectrodes à haute densité et à haute résolution spatiale, permettant la détection de ces informations cellulaires ainsi que l’obtention d’un rapport signal sur bruit élevé par le biais de dépôt de noir de platine. De tels réseaux peuvent avoir 26400 microélectrodes sur un réseau de détection de 3,85 x 2,10 mm². Avec un pas de 17,5 μm, la densité d'électrodes est de 3265 électrodes par μm² pour accompagner les 1024 canaux de lecture [15] . Avec de nombreux commutateurs sous les électrodes, diverses configurations d'électrodes peuvent être utilisées pour évaluer la population de neurones sur la puce. Avec une telle puce-microélectrode sensible et dense, l'identification d'une cellule, des analyses au niveau du réseau et les informations axonales peuvent être enregistrées à partir des cellules neurales. Cette technologie rend possible de déterminer des «biomarqueurs» pour phénotypes électrophysiologiques pour modéliser des maladies et fonctionnalités des tissus, puisqu'une rétine disséquée peut être plaquée et enregistrée sur un réseau de microélectrodes [16] .
Enregistrements rétiniens[modifier | modifier le wikicode]
Les signaux lumineux sont interprétés dans la rétine et ces informations sont stockées dans les neurones de la couche ganglionnaire, appelés cellules ganglionnaires rétiniennes (CGR). Ces cellules envoient ensuite ces informations via des potentiels d'action qui peuvent être enregistrés par des réseaux de microélectrodes afin de comprendre les circuits rétiniens, leur développement et le codage d'une scène visuelle. Ces expériences in vitro sont généralement effectuées en isolant d'abord la rétine de son tissu natif. Le tissu est alors plaqué avec les cellules ganglionnaires de la rétine dirigées vers le bas sur la matrice et l’enregistrement est fait en utilisant une stimulation lumineuse. Ensuite, les données sont analysées à l'aide de «spike sorting», qui sera expliqué ultérieurement. Des bloquants de médicaments et différents stimuli lumineux peuvent être utilisés pour déterminer la réponse des photorécepteurs et évaluer leur fonctionnalité. En outre, les chercheurs peuvent évaluer l’effet des mutations rétiniennes sur le comportement de production de pics des CGR afin de déterminer les biomarqueurs électrophysiologiques. Dans une expérience, les chercheurs ont utilisé un réseau de microélectrodes pour les rétines de souris de type sauvage et de souris avec knock-out FRMD7. FMRD7 est une mutation associée à des mouvements oculaires rapides, horizontaux et dépendants du regard, chez les individus affectés. Les données des sessions d’enregistrement sur le réseau de microélectrodes ont indiqué qu’il y avait une perte de réponse des cellules sélectives pour la direction horizontale dans la rétine. Les souris de type sauvage n'ont pas perdu de réponse dans les cellules sélectives pour la direction horizontale ou verticale. Une telle découverte indique la possibilité d'utiliser la technologie des réseaux de microélectrodes pour déterminer les biomarqueurs électrophysiologiques des maladies de la rétine dans de futures études [17] .
Spike sorting[modifier | modifier le wikicode]
Grâce aux dernières technologies en matière de microélectrodes qui permettent l'enregistrement neural de milliers d'électrodes, il est possible d'analyser de grandes quantités de données électrophysiologiques simultanées provenant de tissus et de réseaux neuronaux afin de révéler des informations électriques pertinentes sur le système nerveux. Lors de l'utilisation d'un réseau de microélectrodes pour les neurosciences, les signaux électriques des neurones (potentiels d'action) sont enregistrés de manière extracellulaire. Cela signifie que le signal acquis dans ces enregistrements est l'opposé de celui obtenu par la méthode «patch-clamp»; l'amplitude du potentiel d'action est négative à l’opposé de celui obtenu par patch-clamp. Ces signatures extracellulaires contiennent des informations non seulement sur les potentiels d'action, mais également sur des mécanismes synaptiques (potentiels de champ locaux), qui peuvent être identifiés par filtrage et analyse. Le processus d'analyse et d'attribution de ces informations électrophysiologiques à un seul neurone est connu sous le nom de spike sorting.


L'aspect principal d'un enregistrement analysé dans un enregistrement de microélectrode est la suite de potentiels. Un neurone peut être identifié par son activité de pics puisque le timing de chaque événement dépend de la taille, de la forme et de la position du neurone par rapport à l'électrode. Lors de l'enregistrement à partir de milliers de neurones, le spike sorting devient un défi pour l’effet cocktail party. Avec plusieurs neurones proches les uns des autres, il est très facile pour une électrode d’enregistrer les signaux de plusieurs neurones. Par conséquent, le spike sorting doit identifier un seul neurone par son «bavardage» électrique alors que de nombreux «bavardages» en arrière-plan se produisent également. Le spike sorting est un processus en plusieurs étapes qui extrait les données brutes de la population de neurones et attribue des pointes à un seul neurone malgré ce bruit de fond.
Le processus de spike sorting peut comporter les étapes suivantes: Prétraitement des données brutes → Détection de pics → Extraction de pics et alignement → Extraction de caractéristiques → Regroupement → Classification. Dans ce flux de travail général, un algorithme de spike sorting prend les données brutes de la population neuronale et les pré-traite en filtrant la partie basse fréquence du potentiel d’action (bruit). Les pics sont ensuite détectées en définissant un seuil de tension. Ensuite, les formes d’onde de pics extraits doivent être alignées dans le temps, dans le respect d’une caractéristique générale du potentiel d’action, telle que sa position. Ensuite, les caractéristiques sont extraites de chaque forme d'onde individuelle à l'aide d'une analyse en composantes principales ou en ondelettes, ce qui est nécessaire pour réduire les données aux dimensions nécessaires contenant les informations d'intérêt. Les pics sont ensuite regroupés afin de créer un modèle pour un seul neurone. Ceci est fait pour les tous neurones individuels dans les données. Il n’existe pas d’algorithme de tri «unique» pour les pics, car les enregistrements sur plusieurs électrodes peuvent différer d’un type de cellule à l’autre, d’une espèce à l’autre et du type d’enregistrement effectué. Par conséquent, les algorithmes doivent être ajustés et optimisés pour produire des résultats pouvant représenter avec précision les données brutes. Cependant, une fois que les données ont été triées avec précision, il est possible d’acquérir un tas d’informations telles que les intervalles entre pics, les périodes réfractaires et la possibilité de tracer les données de neurones individuels les uns par rapport aux autres pour détecter les différences [18] .
Implants olfactifs[modifier | modifier le wikicode]

L'anosmie (perte d'odorat) apparaît chez environ 5 % de la population générale. Un système olfactif intact est au cœur de la perception du goût en mangeant ou buvant. La plupart des problèmes présentant une perte de goût proviennent d'un trouble olfactif. De plus, la réception de l'odeur est également au cœur de notre qualité de vie. De nombreuses expériences, comme les averses de printemps, les fleurs fraîches ou le parfum de notre maison s'ajoutent à n'importe quel événement, même si elles sont difficiles à décrire. Bien que les causes inflammatoires de la perte d'odeur peuvent être résolues avec l'utilisation de stéroïdes topiques et systémiques, de nombreux traitements pour d'autres causes courantes d'anosmie, y compris l'infection des voies respiratoires supérieures (URI), traumatisme crânien, et le vieillissement n'ont pas prouvé être efficace.

Étude de faisabilité[modifier | modifier le wikicode]
Une étude réalisée par Eric H. Holbrook, Sidharth V. Puram et d'autres chercheurs a permis de déterminer la faisabilité de l'induction de l'odeur par la stimulation électrique artificielle des bulbes olfactifs chez l'humain. Cinq sujets (43-72 ans) ont été inscrits. Trois sujets ont rapporté une perception d’odeur avec une stimulation électrique. Tous les sujets ont toléré l'étude avec un minimum d'inconfort. Les sujets ont tous été en mesure de percevoir des odeurs, ce qui a été confirmé par un test d'identification de 40 odeurs disponible dans le commerce. Sous guidage endoscopique et sans anesthésie topique, une électrode bipolaire ou monopolaire a été positionnée à 3 endroits le long de la lamelle latérale de la plaque cribriforme à la jonction avec la base crânienne : (1) l'éthmoïde antérieur, postérieur à l'ouverture du sinus frontal ; (2) l'éthmoïde postérieur, antérieur à la face sphénoïde ; et (3) le milleu de l'éthmoïde, approximativement à la moitié de la distance entre les points antérieurs et postérieurs[19]. Pendant 0,2-0,3ms, les implants ont été stimulés avec une gamme d'intensité de 1 à 20 mA. 3 des 5 sujets ont rapporté une expérience de l'odorat mais n'ont pas pu clairement indiquer ce à quoi les odeurs ressemblent et il y avait des différences entre eux. La perception de l'odeur n'a pas grandement changé avec des intensités différentes ou dépendament de la localisation de l'électrode, mais de petites déviations décrites comme "sucré", "aigre" ou "mauvais" ont été rapportées. Il n'y avait pas de différence entre les électrodes monopolaires ou bipolaires. L'odeur perçue était décrite comme "semblable à l'oignon", "antiseptique" ou "aigre" et "fruitée" ou "mauvaise". Lorsqu'on leur a demandé de classer les intensités perçues de l'odeur sur une échelle de 1 à 10, le résultat variait de 2 à 4. Tous les sujets ont également éprouvé une certaine gêne avec les dispositifs, qui se sont présentés comme une sensation de battement, de picotement ou de pulsation située à l'électrode de sol, au canthus interne de l'œil, au pont du nez, à la pointe nasale, ou dans un cas profondément derrière l'œil. Les électrodes placées dans la fissure olfactive provoquaient des éternuements ou de l'inconfort chez quatre des sujets et chez le seul qui les a tolérées, aucune perception de l'odeur n'a été entraînée. En conclusion, l'étude a permis la perception de l'odeur avec la stimulation électrique du bulbe olfactif pour la première fois. Les auteurs envisagent d'explorer encore plus l'utilisation de tels implants, en déclarant : "Les travaux futurs étendront les essais pour inclure des sujets sans sens de l'odorat et développer des mesures objectives plus cohérentes de la perception olfactive." Cette étude n'était qu'une preuve de concept pour de futures recherches sur la possibilité de restaurer l'olfaction de la perte d'odeur avec la technologie de stimulation électrique[20].
Mesure électronique des odeurs[modifier | modifier le wikicode]
Aujourd'hui, les odeurs peuvent être mesurées électroniquement de nombreuses manières différentes, comme par exemple : spectrographie de masse, chromatographie en phase gazeuse, spectres raman et plus récemment nez électroniques. En général, il est supposé que les différents récepteurs olfactifs ont des affinités différentes avec des propriétés physico-chimiques moléculaires spécifiques, et que l'activation des différents récepteurs donne lieu à un modèle spatio-temporel d'activité qui reflète les odeurs.
Nez électronique[modifier | modifier le wikicode]

Les E-nez sont des dispositifs artificiels de détection des odeurs basés sur un groupe de capteurs chimiques et la reconnaissance de motifs. Ils sont utilisés pour identifier et quantifier les substances dissoutes dans l'air (ou dans d'autres substances porteuses). Un e-nez se compose d'un dispositif d'échantillonnage (analogue au nez), d'un groupe de capteurs (analogue aux neurones récepteurs olfactifs) et d'une unité de calcul (analogue au cerveau).
Capteurs[modifier | modifier le wikicode]
Comme dans le nez des animaux, des capteurs non spécifiques sont utilisés. Ceci est non seulement dû au fait qu'il est très difficile de trouver des capteurs très spécifiques, mais on veut également couvrir une vaste gamme de composés sans capteur pour chacun d'entre eux. En outre, il est plus robuste, précis et efficace si le traitement de données est basé sur des informations de plus d'un capteur. Ces capteurs subissent un changement de leurs propriétés électriques (par exemple une résistance plus élevée) lorsqu'ils entrent en contact avec un composé. Cette modification entraîne un changement de tension qui est numérisé (convertisseur AD).
Les types de capteurs les plus fréquemment utilisés sont les semi-conducteurs à oxyde métallique (MOS), les microbalances à cristaux de quartz (QCM), les polymères conducteurs (CP) et les capteurs d'ondes acoustiques de surface (SAW). Une autre technologie prometteuse est celle des nez bioélectroniques qui utilisent des protéines comme capteurs. Il est également possible d'utiliser une combinaison de différents capteurs pour obtenir un résultat plus précis et combiner les avantages de plusieurs types de capteurs, par exemple une meilleure réactivité temporelle par rapport à une meilleure sensibilité.
Exemple: principe de fonctionnement d'un capteur de polymères conducteurs[modifier | modifier le wikicode]
Un capteur de polymères conducteurs se compose d'un groupe d'environ 2-40 polymères conducteurs différents (longues chaînes de molécules organiques). Certaines molécules d'odeur pénètrent dans le film de polymères et provoquent l'expansion du film, augmentant ainsi sa résistance. Cette augmentation de la résistance de nombreux types de polymères peut s'expliquer par la théorie de la percolation.[21] En raison des propriétés chimiques des matériaux, différents polymères réagissent différemment à la même odeur.
Calcul[modifier | modifier le wikicode]
Le signal du capteur doit être associé à un mélange d’odeurs avec un algorithme de reconnaissance des formes. Il est possible de créer une base de données de combinaisons potentielles et de trouver la meilleure correspondance avec des méthodes statistiques multivariées lorsqu'une odeur est présentée ou qu'un réseau neuronal peut être formé pour reconnaître les motifs. Souvent, l'analyse des composants principaux est également utilisée pour réduire la dimensionnalité des données du capteur.
Applications[modifier | modifier le wikicode]
Il existe de nombreuses applications pour les e-nez. Ils sont utilisés dans l'aérospatial et dans d'autres industries pour détecter et surveiller les substances dangereuses ou nocives et pour le contrôle de la qualité. Les applications possibles en matière de sécurité sont la détection de drogues ou d'explosifs. Les e-nez pourraient un jour remplacer les chiens policiers. Une application très puissante pourrait être le diagnostic de maladies qui modifient la composition chimique de la respiration ou l'odeur des excrétions ou du sang, remplaçant ainsi potentiellement les techniques de diagnostic invasives. Il peut également être utilisé pour diagnostiquer le cancer, car certaines cellules cancéreuses peuvent être identifiées par leur profil de composés organiques volatils. Le diagnostic du cancer par l'odorat a déjà montré fonctionner avec les chiens, les mouches,[22] mais des méthodes pratiques appropriées avec une sensibilité et une spécificité élevées sont encore en cours de développement. Une autre application médicale est le traitement de l'anosmie (incapacité à percevoir l'odeur) par un implant olfactif sur la base d'un nez électronique. Cela aussi est encore en développement. En revanche, les e-nez sont déjà utilisés pour la surveillance et la protection de l'environnement. En robotique, les e-nez pourraient être utilisés pour suivre les odeurs aériennes ou les odeurs au sol. En particulier pour la robotique, il serait très intéressant d’avoir une meilleure compréhension du système olfactif de l’insecte, puisque pour utiliser l’odeur pour naviguer ou localiser les sources d’odeurs, il faut utiliser les informations temporelles du stimulus, souvent négligées.
Sources[modifier | modifier le wikicode]
- ↑ Larry Squire, et al, Fundamental Neuroscience 4th edition,
- ↑ 2,0 2,1 et 2,2 Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun, « Retinal stimulation strategies to restore vision: Fundamentals and Systems », dans , 2016
- ↑ Jackson, G.R., Owsley, C., Curcio, C.A, « Photoreceptor degeneration and dysfunction in aging and age-related maculopathy. », dans , 2002
- ↑ Shigeru Sato, Yoshihiro Omori, et al, « Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation », dans , 2008
- ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann, « Count and density of human retinal photoreceptors », dans , Springer, 1992
- ↑ Ashmore Jonathan, « Cochlear Outer Hair Cell Motility », dans , American Physiological Society, 2008
- ↑ 7,0 et 7,1 Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky, « High-Resolution Electrical Stimulation of Primate Retina for Epiretinal Implant Design », dans , Society of Neuroscience, 2008
- ↑ Jong-Mo Seo, et al, « Biocompatibility of polyimide microelectrode array for retinal stimulation », dans , 2004
- ↑ Eui Tae Kim, et al, « Feasibility of Microelectrode Array (MEA) Based on Silicone-Polyimide hybride for retina prosthesis », dans , 2009
- ↑ 10,0 et 10,1
- ↑ Pritchard Roy, « Stabilized Images on the Retina », dans Scientific American, 1961
- ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor, « Carbon nanotube electrodes for effective interfacing with retinal tissue », dans , 2009
- ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler, « Stimulation with a Wireless Intraocular Epiretinal Implant Elicits Visual Percepts in Blind Humans », dans , The Association for Research in Vision and Ophthalmology, 2011
- ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent, « A model retinal interface based on directed neuronal growth for single cell stimulation », dans , Springer, 2006
- ↑ Jan Muller, et al, « High-resolution CMOS MEA platform to study neurons at subcellular, cellular, and network levels », dans , 2015
- ↑ Fiscella M, et al, « Recording from defined populations of retinal ganglion cells using a high-density cmos-integrated microelectrode array with real-time switchable electrode selection », dans , 2012
- ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B and Hierlemann A, « Screening Transgenic Mouse Models of Human Eye Diseases with CMOS High-Density Microelectrode Arrays », dans , 2016
- ↑ Gaute T Einevoll, Felix Franke, Espen Hagen, Christophe Pouzat, and Kenneth D Harris, « Towards reliable spike-train recordings from thousands of neurons with multielectrodes », dans , 2012
- ↑ Holbrook EH, Puram SV, See RB, Tripp AG, Nair DG., « Induction of smell through transethmoid electrical stimulation of the olfactory bulb. », dans Int Forum Allergy Rhinol., vol. 2019;9, 2019, p. 158-164
- ↑ Holbrook EH, Puram SV, See RB, Tripp AG, Nair DG., « Induction of smell through transethmoid electrical stimulation of the olfactory bulb. », dans Int Forum Allergy Rhinol., vol. 2019;9, 2019, p. 158-164
- ↑ K. Arshak, « A review of gas sensors employed in electronic nose applications », dans Sensor Review, vol. 24, no 2, June 2004, p. 181–198 [lien DOI]
- ↑ Martin Strauch, « More than apples and oranges - Detecting cancer with a fruit fly's antenna », dans Scientific Reports, vol. 4, 6 January 2014 [lien DOI]


