Neurosciences/Le métabolisme des neurotransmetteurs
Dans le chapitre précédent, nous avons passé en revue les neurotransmetteurs principaux et avons survolé leur fonction, leur effet sur le cerveau. Nous avons ainsi fait connaissance avec la sérotonine, la dopamine, les catécholamines, la mélatonine, et bien d'autres encore. Dans ce chapitre, nous allons voir comment ces neurotransmetteurs sont fabriqués à partir d'acides aminés ou de précurseurs présents dans l'alimentation. Nous allons voir que de nombreuses enzymes permettent de fabriquer les neurotransmetteurs, tandis que d'autres participent à leur dégradation. Nous verrons aussi que divers médicaments, utilisés en psychiatrie ou en neurologie, agissent sur ces enzymes pour moduler les niveaux des neurotransmetteurs, leur production, leur dégradation, etc. Enfin, nous verrons que certaines maladies proviennent de déficiences en enzymes qui participent à la fabrication des neurotransmetteurs principaux.
Le métabolisme de l'acétylcholine
[modifier | modifier le wikicode]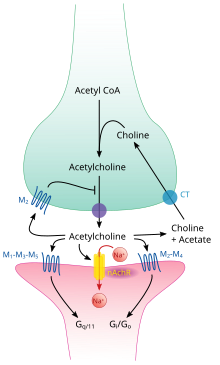
Cette molécule est synthétisée à partir d'un acide aminé nommé choline, et d'acetylco-A, une substance chimique faisant partie prenante de la chaine respiratoire et du cycle de Krebs. Cette synthèse est réalisée par une enzyme : la choline-acétyl-transférase.
L'acétylcholine n'est pas recapturée par les neurones émetteurs, mais est dégradée par une enzyme : l'acétylcholinestérase. Cette enzyme est de loin l'une des plus efficaces du corps humain : elle est capable de dégrader 25 000 molécules d'acétylcholine par seconde !
Le produit de la dégradation est une molécule de choline secondée par une molécule d'acétate. La molécule de choline est alors recapturée par les neurones, afin de former de nouvelles molécules d'acétylcholine.
 |
 |
Il existe de nombreux médicaments qui inhibent l'activité de l'acétylcholinestérase, la plupart étant utilisés pour soigner la myasthénie (une maladie caractérisée par la disparition partielle des récepteurs à l'acétylcholine sur les muscles). Ces médicaments sont aussi utilisés chez les patients déments, notamment dans le traitement de la maladie d'Alzheimer, en raison de l'implication de l'acétylcholine dans les aires cérébrales liées à la mémoire. Mais les faibles bénéfices de ces médicaments font qu'ils sont de moins en moins utilisés pour cette indication. Outre les médicaments, certaines armes chimiques, comme le gaz sarin, suppriment l'action de l'acétylcholinestérase, ce qui cause rapidement une accumulation d'acétylcholine dans les synapses. Ils entrainent une paralysie totale qui cause rapidement la mort par arrêt des muscles respiratoires et cardiaques.
Le métabolisme des neurotransmetteurs aminés
[modifier | modifier le wikicode]Tous les neurotransmetteurs aminés ne sont pas synthétisés de la même manière. Dans les grandes lignes, on peut séparer la synthèse du glutamate/GABA des autres voies de synthèse.
Le métabolisme du GABA et du glutamate
[modifier | modifier le wikicode]
Le glutamate est synthétisé à partir de glutamine, une substance apportée par l'alimentation, ou d'alpha-cétoglutarate. La synthèse peut se faire par deux voies différentes, l'une utilisant la glutamine et l'autre l'alpha-cétoglutarate. Dans la seconde voie, l'alpha-cétoglutarate est modifié par l'enzyme transaminase, qui catalyse la réaction chimique suivante :
- Aspartate + Alpha-cétoglutarate Oxaloacétate + Glutamate
La seconde voie transforme la glutamine en glutamate. Elle est catalysée par l'enzyme glutaminase.
- L-glutamine + L-glutamate +
Le glutamate est transformé en GABA par une enzyme, la glutamate décarboxylase. Pour fonctionner, l'enzyme qui dégrade le glutamate en GABA a besoin d'utiliser le pyridoxal, un dérivé de la vitamine B6. Le manque de vitamine B6 peut ainsi entrainer une baisse de la production cérébrale de GABA, qui se traduit par une hausse de l'activité électrique des neurones. Il est facile de deviner que les premières conséquences cérébrales d'une déficience en vitamine B6 sont une hausse de l'anxiété, des troubles du sommeil et parfois des crises épileptiques. La réaction catalysée par la glutamate décarboxylase est la suivante :
- L-glutamate L-GABA +
Le GABA est ensuite dégradé par plusieurs enzymes (après utilisation) en acide succinique, qui est lui-même utilisé pour redonner de l'alpha-cétoglutarate, un des précurseurs du glutamate. La transformation de l'acide succinique en alpha-cétoglutarate se fait par le cycle de Krebs.
Le métabolisme de la glycine
[modifier | modifier le wikicode]La glycine est synthétisée à partir de deux voies enzymatiques différentes. La première transforme la sérine (un autre acide aminé) en glycine. Elle est catalysée par une enzyme nommée sérine hydroxyméthyltransférase, qui a besoin de vitamine B6 comme co-enzyme. La réaction chimique en question est la suivante :
- Sérine + Tétrahydrofolate Glycine + Méthyléne Tétrahydrofolate +
Une seconde réaction, qui a lieu dans le foie, est la suivante :
- + + Méthyléne Tétrahydrofolate + + Glycine + Tétrahydrofolate +

La glycine est ensuite dégradée par plusieurs voies enzymatiques différentes, trois au total. La première d'entre elle est une voie catalysée par plusieurs enzymes, regroupées sous le terme de Glycine cleavage system. En tout, celui-ci contient quatre enzymes, nommées T-protein, P-protein, L-protein et H-protein. La réaction catalysée par cette voie enzymatique est l'inverse de la seconde voie de synthèse, à savoir :
- Glycine + Tétrahydrofolate + + + Méthyléne Tétrahydrofolate + +
Le métabolisme des monoamines
[modifier | modifier le wikicode]Les monoamines sont fabriquées à partir de précurseurs et plus précisément d'acides aminés (d'où le nom de monoamines). L'acide aminé dépend cependant du neurotransmetteur en question. Les monoamines sont dérivées des acides aminés suivants : l'histidine, le tryptophane et la tyrosine/phénylalanine. Vous remarquerez qu'il y a moins de précurseurs que de monoamines et c'est normal : certaines monoamines partagent le même précurseur aminé, quand certaines ne sont pas fabriquées à partir d'une autre monoamine. Par exemple, la dopamine, la noradrénaline et l'adrénaline sont toutes synthétisées à partir d'un même précurseur : la tyrosine. Il en est de même pour la sérotonine et la mélatonine, qui sont toutes deux fabriquées à partir d'un même précurseur : le tryptophane, un acide aminé. Dans les grandes lignes, on distingue trois grandes classes de monoamines, qui sont synthétisées à partir d'un précurseur identique : l'histamine est à part, les catécholamines (dopamine, noradrénaline, adrénaline) et les tryptamines (sérotonine et apparentés).
Le métabolisme des monoamines implique un grand nombre d'enzymes et de coenzymes, dont certaines sont impliquées dans la fabrication de plusieurs monoamines. Par exemple, la dopa-decarboxylase est l'enzyme qui fabrique la sérotonine, la dopamine et l'histamine, à partir de leurs précurseurs respectifs. La même enzyme est donc utilisée pour synthétiser plusieurs monoamines différentes. Le même cas a lieu pour la dégradation des monoamines, seules quelques enzymes suffisent à détruire toutes les monoamines. Les monoamines sont toutes dégradées par quelques enzymes : la COMT et les monoamines oxydases. De ce fait, nous devons présenter le métabolisme des monoamines ensemble, en séparant quelques voies métaboliques distinctes, mais qui partagent les enzymes citées précédemment.

Le métabolisme des catécholamines
[modifier | modifier le wikicode]
Les catécholamines sont créées à partir de deux molécules : la phénylalanine et la tyrosine. La tyrosine et la phénylalanine sont présentes toutes deux dans l'alimentation. En cas de manque de tyrosine, la phénylalanine peut se transformer en tyrosine. La tyrosine est ensuite dégradée en lévodopa, aussi appelée L-DOPA. La lévodopa va ensuite être transformée en dopamine, elle-même transformée en noradrénaline, elle-même transformée en adrénaline. Détaillons cependant un petit peu les diverses réactions chimiques présentées dans le schéma ci-contre.
La première réaction, facultative, transforme la phénylalanine en tyrosine par la phénylalanine-hydroxylase, une enzyme surtout présente dans le foie, beaucoup moins dans les autres tissus. Elle demande la présence de co-enzymes : oxygène, fer et tétrahydrobioptérine. Une maladie génétique, nommée phénylcétonurie, entraine un manque de cette enzyme dans le foie, ce qui cause un déficit chronique en tyrosine et en catécholamines. Son symptôme principal est une déficience intellectuelle d'apparition progressive, accompagnée de troubles psychiatriques et de crises épileptiques. Il faut noter que certains cas de phénylcétonurie proviennent non pas d'une non-synthèse de la phénylalanine hydroxylase, mais d'un défaut de production de la tétrahydrobioptérine, un cofacteur important de la réaction chimique.
Par la suite, la tyrosine est dégradée en levodopa par la Tyrosine-hydroxylase, aussi appelée Tyrosinase. Cette enzyme est codée par un seul gène nommé TH, qui est exprimé dans le cerveau et dans d'autres tissus. La réaction demande la présence d'oxygène, de l'ion et de tétrahydrobioptérine, comme la réaction précédente. Cette réaction est la plus lente dans la chaine de production des catécholamines et est donc la réaction limitante pour leur fabrication. Les quantités de tyrosine sont toujours suffisantes pour saturer la Tyrosine hydroxylase, ce qui fait que la production de levodopa ne dépend pas des quantités disponibles de tyrosine. En clair, on ne peut pas augmenter la production de catécholamines en se complémentant en tyrosine, contrairement à ce que certains fabricants de compléments alimentaire prétendent.


La L-DOPA est ensuite métabolisée, avec deux possibilités : soit elle est dégradée en 3-méthoxytyrosine par la COMT, soit elle est transformée en dopamine par la dopa-décarboxylase. La dopa-décarboxylase, aussi appelée aromatic L-amino acid decarboxylase (AADC), est une enzyme dérivée de la vitamine B6. Elle est présente aussi bien dans le cerveau que d'autres tissus, et notamment dans le sang, où elle est fortement active. La lévodopa sanguine est majoritairement rapidement dégradé avant même d'atteindre le cerveau, par la dopa-décarboxylase sanguine. Seule une minorité de la lévodopa atteint le cerveau, où elle est métabolisée en dopamine par la dopa-décarboxylase. On peut signaler que ce métabolisme sanguin de la lévodopa pose quelques problèmes pour utiliser la lévodopa comme médicament. En effet, la lévodopa est utilisée comme médicaments dans des maladies caractérisées par un manque de dopamine cérébrale et notamment dans la maladie de Parkinson. Mais une bonne partie des comprimés est métabolisé dans le sang, ce qui réduit l'efficacité du médicament, tout en causant de nombreux effets secondaires périphériques. Pour éviter cela, la lévodopa est associée avec un inhibiteur de la dopa-décarboxylase. À ce propos, il est déconseillé de prendre en même temps des médicaments à base de lévodopa et de la vitamine B6 en même temps : la vitamine B6 risque d'accélérer la dégradation de la L-DOPA avant son arrivée au cerveau, réduisant fortement l'efficacité du traitement.
La dopamine est elle-même transformée en noradrénaline, par la dopamine hydroxylase. Pour fonctionner, celle-ci a besoin d'oxygène, de cuivre, et de vitamine C. Cela expliquerait l'effet stimulant de la prise de vitamine C, sous réserve que les quantités de cuivre sanguins soient suffisantes.

La transformation de la noradrénaline en adrénaline demande une enzyme : la Noradrénaline N-méthyl transférase. Cette réaction demande une certaine quantité de SAM-e, un composé chimique utilisé en médecine naturelle pour d'éventuels effets (encore non-prouvés, mais suspectés) sur la dépression.

Le métabolisme des tryptamines
[modifier | modifier le wikicode]
Les tryptamines sont synthétisées à partir d'un acide aminé : le tryptophane. Le tryptophane est transformé en sérotonine, qui est elle-même transformée indirectement en mélatonine. La sérotonine est fabriquée à partir de 5-HTP (5-hydrotryptophane), lui-même fabriqué à partir de tryptophane. L'ensemble des réactions chimiques est détaillé ci-contre.

Le processus commence par la transformation du tryptophane en 5-HTP (5-hydrotryptophane), une réaction catalysée par la tryptophane-décarboxylase. La réaction a besoin de la présence de plusieurs co-enzymes, dont la tétrahydrobioptérine et quelques "minéraux" (du Fer, de l'Oxygène). Cette réaction chimique ne se produit pas que dans le cerveau, mais partout dans le corps. Sur la totalité du tryptophane converti en 5-HT, seule une minorité est converti dans le cerveau même : la majorité est transformée dans le sang.
Le 5-HTP est ensuite converti en sérotonine par l'intermédiaire de la dopa-décarboxylase, une enzyme qui catalyse aussi la transformation de lévodopa en dopamine. Cette réaction chimique a besoin, pour fonctionner, de la présence de vitamine B6. Cela explique pourquoi une carence en vitamine B6 entraine une sous-production de sérotonine, ce qui peut se traduire par une dépression ou d'autres symptômes. Pour information, vous trouverez peut-être du 5-HT en automédication dans certaines pharmacies, pour soigner des troubles liés à la sérotonine, comme l'insomnie, la dépression ou d'autres problèmes du quotidien (stress, nervosité, ...). L'idée est d'augmenter la production de sérotonine, en fournissant le 5-HT nécessaire à sa fabrication. Malheureusement, cette stratégie a peu de chances de marcher pour une raison assez simple : 90% du 5-HT absorbé est métabolisé en sérotonine dans le sang, avant d'arriver au cerveau. Et la sérotonine sanguine ne peut pas rejoindre le cerveau, qui est protégé par ce qu'on appelle la barrière hémato-encéphalique, une barrière qui empêche le passage de certaines molécules du sang vers le cerveau. On devine donc que la supplémentation en 5-HT a peu de chances d'agir sur le cerveau.

Une partie de la sérotonine produite par le cerveau est transformée en mélatonine, une hormone qui régit le rythme veille-sommeil. Cette transformation est indirecte, dans le sens où elle passe par un intermédiaire : la N-acétylsérotonine. Une première enzyme catalyse la transformation de sérotonine en acétylsérotonine, tandis qu'une seconde catalyse la transformation de l'acétylsérotonine en mélatonine.

Le métabolisme de l'histamine
[modifier | modifier le wikicode]
L'histamine est fabriquée à partir d'histidine, via deux réactions métaboliques différentes, l'une faisant intervenir la dopa-décarboxylase, l'autre faisant intervenir l'histidine-methyl-transferase. Chez les animaux peu évolués, la transformation de l'histidine en histamine est catalysée par la Dopa-décarboxylase, aidée par la vitamine B6. Chez l'humain, cette voie métabolique n'est pas utilisée et seule l'autre enzyme effectue la réaction. L'histidine-methyl-transferase catalyse la réaction chimique suivante, qui transforme l'histidine en histamine et en CO2. L'enzyme ne fonctionne qu'en présence d'une coenzyme, le phosphate de pyridoxal. Il ne s'agit ni plus ni moins que d'un dérivé de la vitamine B6 (le pyridoxal). Comme quoi, la vitamine B6 sert de coenzyme pour la fabrication de toutes les monoamines.
L'histamine est dégradée en N-methyl-histamine, qui est ensuite évacuée dans les urines. Cette réaction chimique peut s'effectuer de deux manières différentes, chacune catalysée par sa propre enzyme. La première réaction fait intervenir l'enzyme histamine-méthyl-transférase, alors que l'autre fait intervenir la diamine-oxydase. Cette dernière catalyse la réaction suivante :
- Histamine + eau + dioxygène = (imidazol-4-yl)acétaldéhyde + NH3 + H2O2.
Par la suite, les monoamines oxydases dégradent le N-methyl-histamine non-excrété en acide N-méthyl-imidazole-acétique.
La dégradation des monoamines
[modifier | modifier le wikicode]Comme dit plus haut, les monoamines sont dégradées par plusieurs enzymes. Les deux enzymes les plus importantes sont : les monoamine-oxydases, au nombre de deux (MAO-A et MAO-B) et la cathécolamine-methyl-transferase (COMT). Là où la COMT est spécialisée dans la dégradation des catécholamines, les monoamine-oxydase (MAO) dégradent toutes les monoamines, sauf peut-être à l'exception de l'histamine chez certains animaux. Ces enzymes régulent la quantité de monoamines dans les synapses et elles sont impliquées dans de nombreux processus neurologiques et psychiatriques
Les MonoAmine-Oxydase (MAO) sont au nombre de deux : la MAO-A et la MAO-B. Ces deux enzymes ne dégradent pas exactement les mêmes neurotransmetteurs. Là où la MAO-A dégrade toutes les monoamines, la MAO-B est plus spécialisée dans la dégradation de la dopamine. Cette différence a une utilité clinique, dans le sens où cibler telle ou telle MAO n'aura pas les mêmes effets. Les médicaments qui agissent sur la MAO-A auront une action générale, à la fois noradrénergique, dopaminergique et sérotoninergique, alors que les médicaments agissant sur la MAO-B seront exclusivement dopaminergiques. Les médicaments en question sont des inhibiteurs de la monoamine-oxydase, qui empêchent les MAO de fonctionner, réduisant la destruction des neurotransmetteurs ciblés. Les inhibiteurs de la MAO-A sont des médicaments qui ont pour but d'augmenter la quantité de sérotonine, de noradrénaline et de dopamine cérébrale. Ils étaient utilisés comme anti-dépresseurs, mais ont aujourd'hui été remplacés par les inhibiteurs de récapture de la sérotonine, plus spécifiques (ces derniers agissent seulement sur la sérotonine, pas sur les autres monoamines). D'autres médicaments inhibent exclusivement la monoamine-oxydase B et servent de dopaminergiques. Ils sont utilisés dans le traitement de la maladie de Parkinson.

La dégradation des catécholamines est réalisée à la fois par la monoamine oxydase et par la COMT. Cependant, ces enzymes peuvent agir dans le désordre : soit la MAO agit en première suivie par la COMT, soit les réactions ont lieu dans l'ordre inverse. Un bon exemple est le cas de la dégradation de la dopamine en acide homovanillique, illustré ci-dessous. On voit qu'il y a deux voies de dégradation, qui impliquent toutes deux la COMT et la MAO, mais dans des ordres différents. Dans la première voie, la dopamine est dégradée par la COMT en 3-méthoxythyramine, avant d'être transformée par la MAO en acide homovanillique. Dans la seconde voie, la MAO agit en premier et donne de la DOPAC, qui est elle-même convertie en acide homovanillique par la COMT.

Le cas de la noradrénaline est encore plus compliqué, avec des réactions supplémentaires. La réaction est elle aussi dégradée par la Monoamine oxydase et par la COMT, ces deux dégradations sont suivies de quelques réactions diverses.

La sérotonine, quant à elle, est dégradée en acide 5-hydroxyindolacétique (5-HIAA), un composé qui est éliminé dans le sang et excrété par les urines. Cette dégradation est catalysée par la monoamine-oxydase de type A, qui catalyse aussi la dégradation d'autres monoamines, comme la dopamine.
Le métabolisme des neuropeptides
[modifier | modifier le wikicode]Comme dit dans les chapitres précédents, les neuropeptides sont des protéines qui servent de neurotransmetteur. Leur synthèse et leur dégradation est quelque peu à part des autres neurotransmetteurs. Déjà, leur grande taille fait que leur synthèse est plus complexe. De plus, les neuropeptides ne sont pas recapturés par les neurones, les neuropeptides étant trop gros pour être recapturé efficacement. Le fait que ce sont des protéines joue aussi quant à leur dégradation, le clivage des protéines étant le fait d'enzymes spécialisées nommées peptidases.
De plus, les neuropeptides sont émises en même temps que des neurotransmetteurs classiques. Un neurone qui émet des neuropeptides n'est pas spécialisé et émet à la fois des neurotransmetteurs classiques en même temps que les neuropeptides. Les vésicules synaptiques de ces neurones sont de deux types : des petites vésicules avec seulement du neurotransmetteurs classique, et des grosses vésicules qui contiennent un mélange neuropeptide/neurotransmetteur classique. Si le neurone est stimulé avec des impulsions à faible fréquence, seules les petites vésicules fusionnent avec la membrane. L'émission se limite alors à des neurotransmetteurs classiques. Mais si la fréquence de stimulation est plus forte, les grosses vésicules fusionnent et le neurone émet des neuropeptides en plus.
La synthèse des neuropeptides
[modifier | modifier le wikicode]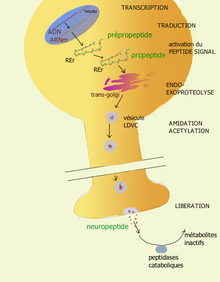
Les neuropeptides sont produits au niveau du corps cellulaire du neurone, par traduction directe d'ADN dans les ribosomes. La molécule synthétisée par les ribosomes est une protéine inactive, appelée pro-peptide. Celle-ci est activée en une protéine active, capable de faire ce qu'on lui demande. Elle est alors placée dans une vésicule par les corps de Golgi. Ce n'est qu'ensuite que les vésicules peptidiques sont transportées vers le bout de l'axone par un système de transport axonal lent. C'est à la suite de ce processus que la molécule peut être sécrétée dans la synapse. Elles peuvent alors agir sur leurs récepteurs, avant d'être dégradées en métabolites inactifs.
Dans ce qui va suivre, nous allons voir la synthèse des neuropeptides les plus connus. Nous allons d'abord commencer par voir la synthèse des opioïdes endogènes, ainsi que celle des mélanocortines.
La synthèse des opioïdes endogènes et des mélanocortines
[modifier | modifier le wikicode]Les opioïdes endogènes sont des molécules semblables à la morphine, produites naturellement dans le cerveau. Elles sont classées en cinq catégories : les endorphines, les endomorphines, les enképhalines, les dynorphines, et le reste. Les mélanocortines, quant à elles, regroupent l'ACTH (hormone adrenocorticotrope) et les trois formes de l'hormone melanotrope. Ces neuropeptides ont beau être chimiquement fort différentes, nous allons les voir ensembles. En effet, les mélanocortines sont synthétisées en même temps que certaines endorphines, par clivage d'un même précurseur.
Elles sont synthétisées grâce à l'action de plusieurs gènes. Les plus connus sont le gène des enképhalines, le gène des dynorphines et le gène de la Pro-opiomélanocortine. Ces gènes produisent des précurseurs protéiques, des protéines de grande taille qui sont découpées pour donner les peptides finaux. Ils donnent naissance respectivement aux précurseurs nommés pro-enképhaline, pro-dynorphine et Pro-opiomélanocortine. Pour simplifier, les deux premiers donnent respectivement naissance aux enképhalines et aux dynorphines, alors que le troisième donne les endorphines et les melanocortines. Le clivage des précurseurs protéiniques est réalisé par les prohormones-convertases, un ensemble d'enzymes protéolytiques. Comme leur nom l'indique, elles clivent les précurseurs protéiniques en neuropeptides et en hormones. Il en existe plusieurs, qui portent les noms de PC1 (Prohormone Convertase 1), PC2, PC3, etc.
La pro-enképhaline est produite par un seul gène et, comme son nom l'indique, elle donne naissance aux enképhalines. Elle est la seule source de la met-enképhaline, mais peut aussi produire une partie de la leu-enképhaline (qui est aussi produite par d'autres voies métaboliques). Son clivage donne naissance à six molécules de met-enképhaline et une de leu-enképhaline. Des clivages alternatifs peuvent donner naissance à d'autres opioïdes endogènes, comme l'adrénorphine, l'amidorphine, et quelques autres.
La pro-dynorphine est elle aussi produite par un gène unique, et son clivage donne naissance à de nombreux peptides endogènes. Son clivage produit naturellement certaines dynorphines, mais aussi de la leu-enképhaline.
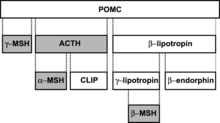
La Pro-opiomélanocortine est un précurseur protéinique, codé par un unique gène. Elle est surtout produite dans les cellules neuro-endocrines de l'hypophyse et de l'hypothalamus, ainsi que dans certaines cellules de la peau. Son clivage donne naissance aux melanocortines, ainsi qu'à quelques molécules de la classe des endorphines. C'est d'ailleurs de là que vient son nom : dans pro-opio-mélanocortine, pro- veut dire précurseur, opio correspond à opioïdes (ici les endorphines), et mélanocortine parle de lui-même. La POMC subit une série de clivages successifs, qui donne naissance à plusieurs peptides. Le premier clivage donne : le peptide CLIP, la bêta-LPH (bêta-Lipotropine) et l'hormone adrénocorticotrope (ACTH). La LPH est ensuite fragmentée pour donner les trois types d'endorphines, mais majoritairement de la bêta-endorphine. L'ACTH et le reste de la molécule sont ensuite découpés pour donner les deux mélanocortines gamma- et alpha-MSH. La succession de clivages est illustré dans le schéma ci-dessous.

La synthèse de l'ocytocine et de la vasopressine
[modifier | modifier le wikicode]L'ocytocine et la vasopressine sont deux hormones chimiquement proches, toutes deux sécrétées par l'hypophyse. Le gène qui code l'ocytocine est situé immédiatement avant celui qui code la vasopressine. Mais seul l'un des deux est exprimé dans un même neurone. Certains neurones expriment le gène pour l'ocytocine, d'autre celui de la vasopressine, mais aucun n'exprime les deux. Quoiqu'il en soit, la synthèse de l'ocytocine se fait comme pour les neuropeptides : par synthèse d'un précurseur qui est clivé en plusieurs molécules. Le précurseur en question s'appelle la pré-pro-ocytocine et contient trois molécules : un peptide signal qui sert pour la signalisation intra-cellulaire, l'ocytocine et la neurophysine. Le précurseur est d'abord débarrassé du peptide signal, puis ce qui reste de la molécule est clivé en ocytocine et neurophysine. L'ocytocine est ensuite modifiée, quelques acides animés étant remplacés et/ou retirés. Le remplacement en question n'est pas exactement le même lors de la vie embryonnaire, de la voie fœtale et adulte, mais c'est là un petit détail.

La dégradation des neuropeptides
[modifier | modifier le wikicode]Les neuropeptides sont dégradés par des enzymes qui portent le nom d'endopeptidases (ce qui se traduit en enzymes dégradant les endo-peptides). La dégradation des neuropeptides module leur effet : plus elles sont dégradées vite, moins elles feront effet.
Les enképhalines sont dégradées par des enzymes appelées enképhalinases. Elles sont assez nombreuses, les plus étudiées étant : l'alanine aminopeptidase, la néprilysine (NEP), la dipeptidyl peptidase 3 (DPP3), la carboxypeptidase A6 (CPA6), la leucyl/cystinyl aminopeptidase (LNPEP) et l'enzyme de conversion de l'angiotensine (ACE). Ces enzymes ont cependant d'autres fonctions physiologiques et la dégradation des enképhalines n'est pas leur fonction principale. Par exemple, la néprilysine dégrade le glucagon, la substance P, la neurotensine, l'oxytocine, et la bradykinine, en plus des enképhalines.
La recapture des neuropeptides
[modifier | modifier le wikicode]Chose importante, les neuropeptides ne sont pas recapturés par les neurones, contrairement aux neurotransmetteurs à faible poids moléculaire. La dégradation par les peptidases étant assez lente, elles restent plus longtemps dans les synapses, ce qui leur permet d'agir très longtemps après leur sécrétion. Elles agissent donc sur de grandes durées de temps, ce qui les rend utiles pour contrôler des processus de moyen-long terme, comme la douleur, la digestion, l'humeur, et bien d'autres processus similaires.
Le métabolisme des endocannabinoïdes
[modifier | modifier le wikicode]
Pour rappel, les endocannabinoïdes sont des neurotransmetteurs produits par le cerveau qui ressemblent aux principes actifs du cannabis (le THC et le cannabidiol). Ils regroupent un ensemble assez important de molécules, qui agissent sur des récepteurs dédiés. Les endocannabinoïdes ont un effet inhibiteur, ce qui fait que leur rôle est d'inhiber les neurones, sous certaines circonstances. Ils réduisent notamment l'émission de dopamine, de sérotonine, de glutamate et d'autres neurotransmetteurs.
La signalisation rétrograde des endocannabinoïdes
[modifier | modifier le wikicode]Fait important, les endocannabinoïdes se distinguent quant à leur sens de transmission synaptique. Les récepteurs aux endocannabinoïdes sont localisés uniquement sur les neurones pré-synaptiques et non sur les neurones post-synaptique. La majorité des autres neurotransmetteurs sont émis par le neurone pré-synaptique et agissent sur le neurone post-synaptique. Mais les endocannabinoïdes font l'exact inverse : ils sont émis par le neurone post-synaptique et agissent sur le neurone pré-synaptique. Une communication synaptique de ce type est appelée une signalisation synaptique rétrograde.
Les endocannabinoïdes sont libérés par les neurones post-synaptiques quand ils sont fortement stimulés. Plus précisément, l'entrée de Calcium dans le neurone post-synaptique active diverses enzymes qui fabriquent les endocannabinoïdes. Les endocannabinoïdes sont ensuite libérés et se déplacent jusqu’au neurone pré-synaptique. Là, ils activent les récepteurs aux endocannabinoïdes (les récepteurs CB1), ce qui réduit l'activité présynaptique. On peut voir ce mécanisme comme un mécanisme de régulation, qui ralentit l'activité cérébrale quand elle est trop importante. Plus un neurone est actif, plus il libère des endocannabinoïdes et plus il ralentit le neurone présynaptique. L'ensemble du mécanisme est illustré ci-contre.
La synthèse des endocannabinoïdes
[modifier | modifier le wikicode]Une particularité des endocannabinoïdes est leur stockage et leur synthèse. Contrairement aux autres neurotransmetteurs, ils ne sont pas stockés dans des vésicules synaptiques et sont produits sur demande immédiate. Les endocannabinoïdes sont synthétisés dans le cerveau à partir de lipides précurseurs et y sont présents en faibles quantités. Ces précurseurs ne sont pas présents dans le cytoplasme des neurones, mais sont enchâssés dans la membrane cellulaire. Les endo-cannabinoïdes sont synthétisés directement dans la membrane neuronale, par l'hydrolyse des précurseurs de la membrane, et sont libérés à l'extérieur du neurone suite à ce processus. Cette synthèse est déclenchée suite à l'entrée de Calcium dans le neurone, suite à l'activation de récepteur synaptiques précis.
La dégradation des endocannabinoïdes
[modifier | modifier le wikicode]Les endocannabinoïdes sont dégradées par plusieurs enzymes, dont la plupart dégradent les acides gras. Les enzymes qui dégradent les acides gras sont en effet bien appropriées pour la dégradation des endocannabinoïdes. En effet, les molécules d'endocannabinoides sont soit des acides gras, soit des dérivés d'acides gras. Les deux principales enzymes qui dégradent les endocannabinoïdes sont la FAAH (fatty acid amide hydrolase, Hydrolase des amides d'acides gras en français) et la Monoacylglycerol lipase. Ces deux enzymes dégradent aussi les endocannabinoïdes, en plus des autres acides gras. Le 2-Arachidonoylglycerol est principalement dégradé par la Monoacylglycerol lipase, secondairement par la FAAH. Environ 85% du 2-Arachidonoylglycerol cérébral est dégradé par la la Monoacylglycerol lipase, 15% par la FAAH. L'amandamide est dégradé par les deux enzymes. L'oléamide est aussi dégradée par la FAAH.
La dégradation des endocannabinoïdes est réalisée par diverses réactions chimiques. Les réactions de dégradation les plus importantes sont des réactions d'hydrolyse, dans lesquelles les endocannabiboïdes sont hydrolysés par la FAAH ou la Monoacylglycerol lipase. Ces réactions produisent de l'acide arachidonique, ainsi qu'un second produit qui dépend de la réaction. Les deux réactions principales sont les suivantes :
- Anandamide + Eau = Acide arachidonique + Éthanolamine (réaction catalysée par la FAAH)
- 2-Arachidonoylglycerol + Eau = Acide arachidonique + Glycérol (réaction catalysée par la Monoacylglycerol lipase)
Le métabolisme des neurostéroïdes
[modifier | modifier le wikicode]Les neurostéroïdes ont une synthèse particulièrement compliquée à analyser. La raison à cela est qu'ils sont dérivés du cholestérol par une série de réactions enzymatiques complexes, série qui possède de nombreuses ramifications. Pour simplifier, les neurostéroïdes sont fabriqués à partir d'hormones sexuelles, elle-mêmes synthétisées à partir de cholestérol. Et ces réactions qui convertissent le cholestérol en hormones sexuelles ont lieu à la fois en dehors du cerveau mais aussi dedans. Les neurostéroïdes sont en effet synthétisés soit à partir d'hormones sanguines qui rentrent dans le cerveau, soit directement dans le cerveau à partir de stéroïdes intracérébraux. Donc, pour expliquer la synthèse des neurostéroïdes, nous n'avons pas d'autre choix que d'expliquer comment sont synthétisés les stéroïdes en général.
Au passage, je viens de dire que les hormones sexuelles peuvent rentrer dans le cerveau. Cela signifie que la quantité de neurostéroïdes varie en fonction de la production d'hormones sexuelles externes. Et cela dépend donc du sexe du sujet considéré. Cela expliquerait aussi pourquoi les hommes sont légèrement souvent frappés d'épilepsie que les femmes, pourquoi les crises épileptiques des hommes sont plus sévères, pourquoi la maladie dure plus longtemps que chez les femmes ou pourquoi la maladie est plus difficile à traiter et demande des doses de médicaments plus fortes chez les hommes. Dans un autre registre, autant la production d'hormones sexuelles est constante chez les hommes, autant elle varie suivant le cycle menstruel et au cours de la gestation chez les femmes. La concentration en neurostéroïdes est donc influencée par le cycle menstruel ou d'autres facteurs extérieurs. Une fois rentrées dans le cerveau, les hormones sexuelles ne servent pas qu'à synthétiser des neurostéroïdes, mais peuvent aussi agir sur les neurones par l'intermédiaire de divers récepteurs membranaires et nucléaires (placés dans le noyau de la cellule). Quant à savoir si cela a une influence quelconque, ou si celle-ci est significative, c'est une autre histoire. Cela jouerait sur certaines maladies, comme la dépression post-partum (après un accouchement) ou sur les crises d'épilepsie cataméniales (qui ont lieu lors des règles). Mais rien de certain à l'heure actuelle.
La synthèse des stéroïdes, en général
[modifier | modifier le wikicode]Pour commencer, rappelons que les stéroïdes peuvent se classer en 5 grandes catégories : les progestatifs, les androgènes, les œstrogènes, et les gluco- et minéralo-corticoïde. La première catégorie regroupe des molécules semblables à la progestérone, une hormone sexuelle femelle. Les androgènes regroupent la testostérone et des molécules semblables, qui sont toutes des hormones mâles. Les œstrogènes regroupent des dérivés de l'estradiol, une hormone femelle. Enfin, les minéralocorticoïdes sont impliqués dans la gestion des sels minéraux, alors que les glucocorticoïdes sont des hormones impliquées dans le métabolisme des sucres et protéines.
La synthèse des stéroïdes commence au niveau du cholestérol, qui est transformé en prégnénolone, qui elle-même convertie en d'autres hormones progestatives. Ces derniers sont alors converties en gluco- et minéralo-corticoïdes, ainsi qu'en androgènes. Les androgènes peuvent ensuite être transformés en oestrogènes. Le tout est illustré dans le schéma ci-dessous.

La synthèse des neurostéroïdes
[modifier | modifier le wikicode]Les neurostéroïdes peuvent se classer en trois groupes : ceux dérivés de la progestérone (une hormone sexuelle femelle), ceux dérivé de la testostérone (une hormone sexuelle mâle), et ceux dérivé de la déoxycorticostérone. Ces stéroïdes/hormones sexuelles sont modifiés par une série d'étapes enzymatiques pour donner des neurostéroïdes. La synthèse en question implique des enzymes spécifiques, comme la 5-alpha-réductase ou la 3-alpha-hydroxysteroïde déshydrogènase. Ces enzymes se retrouvent dans le cerveau, et on en a trouvé des traces dans divers tissus comme le néocortex ou d'autres aires cérébrales, aussi bien dans les neurones que dans les cellules gliales. Mais elles sont aussi présentes dans divers tissus comme le foie ou la peau, ce qui fait que les neurostéroïdes peuvent être fabriqués en périphérie et passer dans le cerveau.
Par exemple, la 5-alpha- et 5-bêta-réductase transforme la progestérone en 5-alpha- et 5-bêta-dyhydroprogestérone. Ces dernières sont ensuite transformées par l'action de la 3-alpha-hydroxysteroïde déshydrogènase et de la 3-bêta-hydroxysteroïde déshydrogènase. Les réactions donnent quatre neurostéroïdes nommés : alloprégnanolone, isopregnanolone, pregnanolone, et épipregnanolone. Les réactions en question sont illustrées ci-dessous.

Les troubles de la synthèse et de la dégradation des neurotransmetteurs
[modifier | modifier le wikicode]Les enzymes qui synthétisent ou dégradent les neurotransmetteurs sont codées par des gènes, qui peuvent subir des mutations. Quand cela arrive, l'enzyme liée au gène ne fonctionne pas correctement. Par exemple, il se peut qu'elle soit produite en excès ou au contraire ne soit pas produite du tout. Plus fréquemment, l'enzyme est synthétisée sous une forme moins efficace, qui dégradent ou synthétisent les neurotransmetteurs moins vite. Dans tous les cas, cela cause un excès ou un manque de neurotransmetteurs spécifiques, qui se traduit par des maladies ou des syndromes bien précis. On détecte ces maladies en étudiant les métabolites des monoamines dans le sang. Si les métabolites sont beaucoup plus élevés que la normale ou que leurs précurseurs sont trop élevés, on a affaire à une des maladies que nous allons présenter ci-dessous. Dans cette section, nous allons étudier les maladies causées par un excès de synthèse de neurotransmetteurs, ainsi que celles causées par un déficit de leur dégradation.
Les troubles métaboliques liés aux monoamines
[modifier | modifier le wikicode]Les troubles des enzymes monoaminergiques impliquent la sérotonine et les catécholamines. Peu de maladies impliquent la synthèse de l'histamine et celles-ci ont généralement un faible retentissement neurologique. Les troubles dépendent du neurotransmetteur en excès ou en déficit, mais les symptômes exacts dépendent de la maladie. Dans le cas général, elles se manifestent par toute une constellation de symptômes, mais les plus courants sont des problèmes de tonus musculaire, un retard mental et des symptômes végétatifs. Leurs symptômes sont variés et ne se limitent pas à des déficits neurologiques, mais peuvent aussi avoir des retentissements cardiaques, immunitaires, ou autres. Rappelons que les neurotransmetteurs sont aussi présents dans le sang et ont une action hormonale, pour la plupart d'entre eux. Vu qu'il s'agit presque toujours de maladies génétiques, elles se manifestent dès l'enfance, ou du moins au cours du développement.
La synthèse des monoamines peut-être perturbée par des mutations de la tyrosine-hydroxylase, de la dopa-décarboxylase, ou de la Dopamine Beta-Hydroxylase. Pour rappel, ces trois enzymes sont impliquées dans la synthèse de la sérotonine et des catécholamines. Elles se caractérisent respectivement par un manque en lévodopa, en dopamine/sérotonine et en noradrénaline. Pour ce qui est de la dégradation des monoamines, des mutations dans les gènes des enzymes COMT et MAO peuvent causer des troubles divers. Par exemple, certaines variantes non-pathologiques de ces gènes, très rependues dans la population, sont liés à des comportements agressifs. Les porteurs de ces gènes ont tendance à être plus agressifs et sont plus souvent responsables de crimes violents que la normale. De plus, certaines maladies génétiques impliquent directement les MAO, comme le syndrome de Brunner.
Commençons par le cas de la déficience en Dopamine Beta-Hydroxylase, qui transforme la dopamine en noradrénaline. Cette maladie est très rare, avec seulement quelques cas connus de par le monde. Elle entraine une absence totale de synthèse de la noradrénaline et de l'adrénaline sanguine, ainsi que par des taux de dopamine sanguine 5 à 6 fois plus élevés que la normale. Elle se manifeste dès l'enfance par des troubles cardio-vasculaires, respiratoires, musculaires, neurologiques et endocrines variés. Ces symptômes sont en grande partie liés au fait que le cerveau ne peut pas ajuster certaines fonctions végétatives dépendantes de la noradrénaline ou de l'adrénaline. Le symptôme le plus marqué est une hypotension, causée par une incapacité à ajuster la tension artérielle pour faire face aux besoins corporels. Ils ont notamment du mal à rester debout ou à se lever. La station debout prolongée ou le fait de se lever entraine chez ces patients une forte chute de tension, qui peut leur faire perdre connaissance (on parle d'hypotension orthostatique - hypotension de la station debout). Leur capacité à faire de l'exercice est fortement limitée et ces patients font régulièrement des syncopes (pertes de connaissances). De plus, leur corps n'arrive plus à ajuster sa température, ce qui entraine de l'hypothermie. Enfin, on observe aussi d'autres symptômes, comme une baisse du tonus musculaire ou des troubles de la glycémie, des vomissements ou une chute des paupières, des troubles sexuels, ... Paradoxalement, cette maladie a peu de retentissement neurologique proprement dit, à savoir qu'elle n'entraine pas l'apparition de symptômes neuropsychiatriques, hormis une légère altération des réflexes et du tonus musculaire !
L'hypotonie lévodopa-sensible est causée par un dysfonctionnement de la tyrosine-hydroxylase, l'enzyme qui fabrique la lévodopa. Elle se caractérise par une sous-production de lévodopa et par une déficience en catécholamines. Cette maladie se traduit cliniquement par un syndrome assez précis. En premier lieu, on observe une baisse du tonus musculaire, d'où le nom d'hypotonie donné à la maladie. On observe ensuite l'apparition d'un syndrome parkinsonien au cours de l'enfance, qui s'aggrave lors de l'adolescence. D'autres formes de mouvements anormaux peuvent apparaitre lors de l'enfance et de l'adolescente. Le traitement de ces maladies se résume donc à apporter la lévodopa non-synthétisée sous la forme de médicament. Encore une fois, il s'agit d'une maladie génétique causée par l'atteinte d'un ou de plusieurs gènes précis. Selon le type de gène touché, on distingue trois types d'hypotonie répondant à la lévodopa : la déficience en tyrosine-hydroxylase, la déficience en GTP cyclohydrolase I et la déficience en Sepiaptérine réductase. Dans le premier cas, la maladie est causée par un manque en tyrosine-hydroxylase, qui n'est pas synthétisée. La maladie est alors à transmission récessive, à savoir que les deux chromosomes pairs doivent avoir le gène muté pour exprimer la maladie. Dans les autres cas, c'est la coenzyme tétrahydrobioptérine qui n'est pas synthétisée, alors que la tyrosinehydroxylase l'est. Et la transmission est alors de type autosomale dominante : la présence d'un seul exemplaire du gène sur un chromosome suffit à exprimer la maladie.
Une déficience en dopa-décarboxylase survient quand le gène qui code l'enzyme dopa-décarboxylase est endommagé. La synthèse de cette enzyme n'a pas lieu, ce qui fait que le 5-HTP et la lévodopa ne sont pas transformées en sérotonine et dopamine. On observe alors une accumulation de 5-HTP et de L-DOPA dans le sang, ainsi qu'un déficit en sérotonine et dopamine assez important. Le tout se manifeste par des symptômes variés, dont les plus courants sont : un retard mental, des troubles du tonus musculaire (dystonie), un syndrome parkinsonien, des troubles végétatifs (du système nerveux autonome). On peut aussi observer d'autres troubles neuropsychiatriques, comme des troubles de l'humeur, de l'agressivité, un comportement autistique, ... Le traitement se fait avec des agonistes dopaminergiques et/ou sérotoninergiques, ou des inhibiteurs de la recapture des monoamines.
Le syndrome de Brunner, ou déficience en MAO-A, est causé par une mutation sur le gène unique qui code cette enzyme. Le gène atteint est localisé sur le chromosome X, ce qui fait que seuls les mâles sont atteints de la maladie, les femmes étant des porteuses saines. Le gène étant défectueux, il ne peut plus synthétiser la MAO-A, ce qui fait que les monoamines ne sont plus dégradées. Le cerveau des personnes atteintes est saturé de dopamine, de sérotonine, de noradrénaline et d'adrénaline. La maladie se manifeste par une déficience intellectuelle modérée, des variations d'humeur, de l'agressivité/impulsivité et des comportements violents, un comportement autistique, etc. Historiquement, cette maladie a été découverte lors de l'étude d'une famille danoise dont les hommes présentaient tous un historique de déficience mentale, d'agressivité grave et de comportements délictueux[1]. La maladie en elle-même est très rare et ne touche que quelques dizaines ou centaines de personnes dans le monde, guère plus.
Les troubles métaboliques liés aux neurotransmetteurs aminés
[modifier | modifier le wikicode]Chez certaines personnes, la production de glutamate-décarboxylase est déficiente, ce qui fait que le glutamate n'est pas transformé en GABA. Par exemple, on suppose que c'est le cas chez les patients atteints du syndrome de l'homme raide, une maladie caractérisée par une rigidité musculaire et une déformation de la posture, parfois accompagnés de spasmes musculaires. Chez ces patients, le sang contient des anticorps dirigés contre le glutamate décarboxylase, ce qui fait que cette enzyme ne peut pas fonctionner comme elle le devrait. Mais le grand nombre de patients avec des anticorps de ce type qui ne déclenche pas la maladie montre que cela ne suffit pas expliquer l'apparition de la maladie.
Précédemment dans le chapitre, nous avons vu que la glycine est dégradée principalement par le Glycine Cleveage System. Chez certains patients, les gènes qui codent les enzymes de ce système sont endommagés ou mutés. Le système enzymatique ne fonctionne pas correctement et la glycine s'accumule dans le corps, entrainant divers troubles neurologiques connus sous le nom d'encéphalopathie liée à la glycine. Ses symptômes principaux sont des crises épileptiques (et plus précisément des crises myocloniques) avec apnées, des troubles du tonus musculaire, un retard mental, des troubles de la conscience et parfois des malformations cérébrales. Il existe plusieurs formes, suivant la protéine touchée (rappelons que le Glycine Cleveage System est un ensemble de quatre enzymes), qui sont de sévérités diverses.
- Dans la forme néonatale, la maladie se déclare dès les premiers jours de vie, avec de profondes crises épileptiques, une hypotonie (faible tonus musculaire), une apnée qui demande une respiration artificielle dans 80% des cas, et des troubles de la conscience allant d’une simple léthargie jusqu'au coma. Les patients récupèrent une respiration normale au bout du premier mois de vie, mais conservent des crises épileptiques et un profond retard mental. Le pronostic est extrêmement mauvais pour ces patients, dont la plupart meurent dès les premières années de vie.
- Dans la forme infantile, les symptômes apparaissent dans l'enfance. On observe des crises épileptiques avec un retard mental, mais peu de troubles de la conscience. Mais on y retrouve les crises épileptiques, ainsi que les troubles respiratoires potentiellement létaux. Les patients expriment souvent des troubles du tonus musculaire, avec une faiblesse musculaire permanente (hypotonie). Le pronostic de ces cas est moins mauvaise que pour la forme précédente, mais il est tout de même particulièrement mauvais.
- Dans les formes tardives, les symptômes sont plus légers que pour les formes précédentes. Les patients ont un retard mental plus modéré, qui peut même être absent, mais qui est le symptôme principal de la maladie. Les symptômes se limitent à de l'épilepsie (mais certains patients sont épargnés) et des troubles moteurs. Ces formes sont beaucoup plus rares que les autres.
La déficience en Succinic-semialdehyde-déhydrogènase est une carence rare en Succinic-semialdehyde-déhydrogènase, une enzyme impliquée dans la dégradation du GABA. Elle est causée par une mutation d'un gène unique, qui code seul l'enzyme incriminée, et ne touche que quelques centaines de personnes dans le monde. À cause de cette déficience, le GABA et quelques molécules dérivées (dont le GHB) s'accumulent dans le corps et le cerveau. Plus précisément, le GABA est bien dégradé en acide succinique semi-aldhéhyde, mais ce dernier n'est plus dégradé en acide succinique. Ce dernier s'accumule donc dans le cerveau et le corps, causant de nombreux symptômes neurologiques. Elle se manifeste pendant la première année de vie par l'apparition progressive de déficits neurologiques divers. On observe un retard mental combiné à des troubles moteurs, comme une mauvaise coordination des mouvements (ataxie), des réflexes atténués (hyporéflexies), ou des troubles du tonus musculaire (hypotonie et dystonies). Près de ma moitié des patients est atteint d'épilepsie, ou encore de troubles psychiatriques (hallucinations, anxiété, dépression, T.O.C, troubles de l'attention, agressivité, autres).
Notes et références
[modifier | modifier le wikicode]












