Neurosciences/Les médicaments du système nerveux
Les médicaments utilisés en psychiatrie et en neurologie agissent tous sur le système nerveux central. Il est d'usage, aussi bien chez les médecins que dans le langage courant, de parler d'anxiolytiques, d'antidépresseurs, de somnifères, de neuroleptiques ou de stimulants. Ces termes réfèrent à des classes de médicaments qui seraient limitées à une maladie bien précise : les antidépresseurs soignent la dépression, les anxiolytiques soignent l'anxiété, les somnifères font dormir, etc. En réalité, il n'est pas rare qu'un antidépresseur soit efficace contre l'anxiété, qu'un neuroleptique soit utilisé comme somnifère, qu'un anti-psychotique serve d'antidépresseur, etc. Dans les faits, les psychotropes se classent assez mal selon leurs indications thérapeutiques. Les termes antidépresseurs/anxiolytiques/anti-psychotiques/somnifères et autres désignent en réalité un mécanisme d'action particulier, qui peut servir à soigner plusieurs maladies différentes.
Les mécanismes d'action des médicaments utilisés en psychiatrie/neurologie
[modifier | modifier le wikicode]Les mécanismes d'action de ces médicaments sont assez variés. Les plus simples agissent sur le métabolisme des neurotransmetteurs, à savoir leur synthèse ou leur dégradation. Les autres médicaments agissent sur les récepteurs des différents neurotransmetteurs.
| Cible thérapeutique | Noms de la catégorie de médicament | Mode d'action | |
|---|---|---|---|
| Métabolisme des neurotransmetteurs | Synthèse des neurotransmetteurs | Molécules précurseures | Augmentent la synthèse d'un neurotransmetteur |
| Dégradation des neurotransmetteurs | Inhibiteurs de la dégradation | Inhibent la dégradation d'un neurotransmetteur | |
| Récepteurs cellulaires | Récepteurs synaptiques | Agoniste/antagoniste des récepteurs synaptiques | Simulent la présence ou l'absence d'un neurotransmetteur bien précis |
| Recapture des neurotransmetteurs | Inhibiteurs des récepteurs de la recapture | Saturent les synapses avec un neurotransmetteur bien précis | |
Les différents types de médicaments du système nerveux central et périphérique
[modifier | modifier le wikicode]Les plus simples sont des molécules précurseurs, qui sont utilisées dans la synthèse des neurotransmetteurs, comme la 5-HT ou la dévodopa (L-DOPA). Ils sont utilisés dans les maladies où survient une déficience en un neurotransmetteur particulier. Par exemple, la maladie de Parkinson entraine une déficience en dopamine intra-cérébrale, qui est corrigée en donnant au malade de la L-DOPA, qui est convertie en dopamine par les mécanismes vus dans les chapitres précédents. Mais il s'agit là d'un cas assez rares, l'utilisation de molécules précurseurs étant peu utilisée, les déficiences en neurotransmetteurs étant rares.
Il existe aussi des médicaments qui facilitent l'émission d'un neurotransmetteur dans la fente synaptique. Par exemple, il existe des médicaments qui facilitent l'émission de dopamine ou de noradrénaline par les neurones pré-synaptique. Ces facilitateurs de l'émission d'un neurotransmetteur sont cependant rares et peu utilisés.
Les agonistes ou antagonistes des récepteurs synaptiques agissent sur les récepteurs synaptiques. Dans le chapitre précédent, on a vu que les récepteurs sont relativement spécialisés, sensibles à un neurotransmetteur bien précis. Par exemple, certains récepteurs ne peuvent interagir qu'avec de la sérotonine, d'autres seulement avec la dopamine, et ainsi de suite. Cependant, cette sélectivité n'est pas parfaite et d'autres molécules peuvent se lier sur un récepteur. Et de nombreux médicaments psychiatrique/neurologiques agissent sur des récepteurs de neurotransmetteurs, qu'il s'agisse de récepteur à la sérotonine, au glutamate, à la dopamine, ou autres. La plupart des médicaments utilisés pour soigner des maladies psychiatriques en sont des exemples notables, qu'il s'agisse d'anti-psychotiques, d'anxiolytiques, de somnifères, ou autre. Mais d'autres agonistes/antagonistes ont des indications purement neurologiques, comme divers médicaments anti-épileptiques, ou ceux utilisés pour soigner Alzheimer ou Parkinson. Aussi, ne vous étonnez pas si ce chapitre parle de certains médicaments utilisés en neurologies ou psychiatrie, ou de leur mécanisme d'action. Difficile de parler de récepteurs synaptiques sans dévier sur le domaine de la neuropharmacologie !
Beaucoup de ces médicaments agonistes/antagonistes de récepteurs synaptiques agissent sur des récepteurs métabotropes, couplés aux protéines G. Et pour rappel, les neurones adaptent la quantité de ces récepteurs en fonction de la demande. Ils peuvent down- ou up-réguler la quantité de récepteurs synaptique quand les récepteurs sont trop ou pas assez activés. Si on les soumets à des doses trop fortes d'agonistes, ils peuvent détruire des récepteurs, ce qui réduit la sensibilité du neurone au neurotransmetteur. Et inversement, des doses d'antagonistes ou d'agonistes inverses peuvent induire une augmentation de la quantité de récepteurs synaptiques. C'est en partie pour cette raison que certains médicaments deviennent de moins en moins efficaces avec le temps. L'augmentation ou diminution de la quantité de récepteur compense l'effet agoniste/antagoniste du médicament. On dit qu'ils entrainent l'apparition d'une tolérance, qui se développe en quelques jours, le temps que les récepteurs disparaissent de la surface des neurones. Cela aura une grande importance pour la suite.

D'autres médicaments agissent non pas sur les récepteurs synaptiques proprement dit, mais sur les récepteurs de recapture des neurotransmetteurs. Ces récepteurs de recapture permettent au neurone pré-synaptique de recycler les neurotransmetteurs émis dans la fente synaptique, après leur utilisation. Les inhibiteurs de la recapture empêchent cette recapture, ce qui fait que les neurotransmetteurs émis restent plus longtemps dans la fente synaptique et agissent plus longtemps. Le cas le plus emblématique est celui des inhibiteurs de la recapture de la sérotonine, qui saturent les synapses en sérotonine. Ils sont utilisés comme anti-dépresseur, anxiolytique, traitement des troubles obsessionnels-compulsifs, plus rarement comme anti-douleur.
Il faut enfin citer les inhibiteurs des enzymes de dégradation. Ils inhibent la dégradation de certains neurotransmetteurs, en agissant directement sur l'enzyme responsable de la dégradation. Les neurotransmetteurs censés être dégradés s'accumulent alors dans les synapses, y restent plus longtemps. Par exemple, certaines molécules inhibent la monoanime-oxydase, qui dégrade sérotonine, dopamine et noradrénaline. Ils sont utilisés pour saturer les synapses de ces trois neurotransmetteurs.
L'effet des médicaments du système nerveux central et périphérique
[modifier | modifier le wikicode]L'effet des médicaments du système nerveux central et périphérique est soit de créer/simuler un excès de neurotransmetteur, soit de créer/simuler une déficience. Par exemple, les inhibiteurs de la recapture et inhibiteurs de la dégradation saturent les synapses en neurotransmetteurs, au même titre que les facilitateurs de l'émission. Ils ont tendance à créer un excès de neurotransmetteurs dans les synapses. Les agonistes des récepteurs synaptiques simulent un excès dans le neurotransmetteur considéré. Par simulent, on veut dire que le neurotransmetteur n'est pas en excès, mais que c'est tout comme du point de vue des récepteurs synaptiques. À l'inverse, les antagonistes et agonistes inverse simulent une pénurie de neurotransmetteur : les neurotransmetteurs sont toujours produits et émis dans la fente synaptique, mais ils n'agissent pas sur les récepteurs synaptique ou leur action est compensée. Du point de vue du neurone, tout se passe comme s'il y avait déficience en neurotransmetteur.
L'effet dépend alors du neurotransmetteur considéré. En soi, les réelles déficiences ou excès de neurotransmetteurs sont rares. Il y a bien le cas de la maladie de Parkinson, où on observe une déficience en dopamine, mais c'est plus une exception qui confirme la règle. Les autres maladies du système nerveux n'impliquent pas de déficience ou d'excès réel. Ce qui ne veut pas dire que les médicaments ne servent à rien, ni qu'il n'ont qu'une utilité purement symptomatique. Les indications de chaque classe de médicament est donnée dans le tableau ci-dessous.
| Mécanisme d'action | Indications | |
|---|---|---|
| Action sur les canaux ioniques | ||
| Bloqueurs des canaux ioniques au sodium |
|
Surtout utilisés comme anti-épileptique et anti-maniaque |
| GABAergiques | ||
| Modulateurs allostériques positifs du récepteur GABA-A : barbituriques, benzodiazépines, non-benzodiazépines |
|
Suivant leur vitesse de dégradation (leur demi-vie), leur indication varie. Les anxiolytiques et anti-épileptiques ont une durée de vie longue, alors que les somnifères ont une demi-vie courte. |
| Histaminergiques | ||
| Antagonistes ou agoniste inverse des récepteurs à l'histamine H1 (Anti-histaminiques anciens) |
|
Ils sont surtout utilisés comme anti-allergiques ou comme médicaments contre le mal de mer. Ils sont rarement utilisés comme somnifères et anxiolytiques, car peu efficaces et avec des effets secondaires assez importants. Leur demi-vie longue fait qu'ils entraînent une somnolence diurne, par exemple. De plus, ils ont une action antagoniste sur les récepteurs cholinergiques, qui sont structurellement semblables aux récepteurs à l'histamine, ce qui est la cause de beaucoup d'effets secondaires : bouche sèche, réduction de la transpiration, constipation, troubles du rythme cardiaque, etc. |
| Sérotoninergiques | ||
| Inhibiteurs sélectifs de la recapture de la sérotonine |
|
|
| Inhibiteurs de la recapture de la sérotonine et de la noradrénaline (bloquent les deux à la fois) | Action principalement sérotoninergique, mais aussi dopaminergique et noradrénergique chez certains médicaments. | |
| Inhibiteurs de la monoamine-oxydase | ||
| Dopaminergiques | ||
| Antagoniste de la dopamine. |
|
Ces médicaments peuvent être utilisés aussi bien comme anti-psychotiques que comme anti-vomitif. Certains de ces médicaments passent très bien du sang dans le cerveau, ce qui permet de les utiliser comme anti-psychotiques. Par contre, ceux qui restent dans le sang sont surtout utilisés comme anti-vomitif et anti-nausées. |
| Agoniste de la dopamine. |
|
|
| Inhibiteurs de la recapture de la dopamine/noradrénaline | ||
| Noradrénergiques | ||
| Inhibiteurs de la recapture de la noradrénaline |
|
Médicaments peu efficaces et peu utilisés, avec des effets secondaires importants (notamment cardiaques). La faible utilisation de ces molécules est liée aux forts effets secondaires de ces médicaments, qui agissent non seulement sur le système nerveux, mais aussi sur le cœur. En prendre quand on est un sujet sain expose à des troubles du rythme cardiaque pouvant être fatals.
Les inhibiteurs de recapture de la noradrénaline étaient utilisés autrefois comme antidépresseurs et anxiolytiques, mais cet usage est tombé en disgrâce du fait de leur faible efficacité et de leurs effets secondaires. Ils ont aussi été utilisés pour les troubles déficitaires de l'attention avec ou sans hyperactivité, et contre la narcolepsie, mais sans grand succès. |
| Facilitateurs de l'émission synaptique de la noradrénaline | ||
| Bêtabloquants (antagonistes des récepteurs béta-adrénergiques) |
|
Les bêtabloquants sont utilisés presque exclusivement en cardiologie et rare est leur utilisation en psychiatrie/neurologie. Le traitement de l'anxiété de performance est une indication est vraiment limitée et peu de médecins proposeront ce genre de traitement pour cette indication. |
| Cholinergiques | ||
| Inhibiteurs de l'acétylcholinestérase |
|
Autrefois utilisés comme traitement symptomatique des démences (Alzheimer, autres), mais aujourd'hui abandonnés car inefficaces |
| Antagonistes des récepteurs cholinergiques |
|
Aussi appelés "curarisants", d'après le nom du curare qui est en le principal représentant |
| Opioïdergiques | ||
| Agonistes des récepteurs opioïdes |
|
Appelés Opioïdes ou morphiniques dans le langage courant, la morphine étant la première molécule de ce type découverte |
| Antagonistes des récepteurs opioïdes |
|
|
Comme vous pouvez le constater en lisant ce tableau ci-dessus, un médicament neuropsychiatrique peut soigner des maladies très différentes. Par exemple, les sérotoninergiques traitent un grand nombre d'affections psychiatriques et neurologiques, allant de la dépression aux douleurs neuropathiques. Idem avec les bloqueurs des canaux ioniques et les GABAergiques, qui sont prescrits dans des indications très variées.
Et inversement une même maladie peut être soignée par des médicaments neuropsychiatriques aux modes d'action totalement différents. Le cas le plus parlant est celui de l'anxiété, qui peut être traité en influençant le GABA, la sérotonine, la noradrénaline, l'histamine, le glutamate, voire les canaux ioniques. Pareil pour les troubles du sommeil, qui peuvent être influencés par les GABAergiques, les antihistaminiques, les bloqueurs des canaux ioniques, les opioïdes, les cannabinoïdes, et j'en passe.
Les sérotoninergiques : les mal-nommés antidépresseurs
[modifier | modifier le wikicode]Les médicaments sérotoninergiques sont souvent appelés des antidépresseurs dans le sens commun, ce qui est un abus de langage. La confusion entre sérotoninergiques et antidépresseurs vient du fait que tous les antidépresseurs récents sont sérotoninergiques, et réciproquement. Mais ça n'a pas toujours été le cas. Le premier antidépresseur découvert était la réboxétine, un inhibiteur de la recapture de la noradrénaline, sans action sur la sérotonine. Il a été suivi par les inhibiteurs de la mono-amine oxydase, qui agissaient sur la dopamine, la noradrénaline et la sérotonine. Les médicaments plus récents sont plus sélectifs et ne ciblent que la sérotonine, afin de limiter les effets secondaires.
Au passage, si les antidépresseurs actuels sont des sérotoninergiques, réduire les sérotoninergiques à des antidépresseurs est vraiment trompeur, même si leur indication principale est la dépression. Ils sont aussi le traitement de référence des troubles anxieux, des troubles obsessionnels-compulsifs, des troubles des impulsions et de quelques autres affections neuropsychiatriques.
Les sérotoninergiques sont le traitement de référence de tous les troubles anxieux, à l'exception des phobies simples : anxiété sociale, anxiété généralisée, troubles de stress post-traumatique, etc. En clair, les antidépresseurs sont aussi des anxiolytiques, même si les anxiolytiques sont souvent confondus avec les GABAergiques, d'où une certaine confusion. Les raisons à cela sont multiples et viennent surtout de l'histoire médicale : il a fallu du temps avant qu'on se rende compte de l'effet anxiolytique des sérotoninergiques, alors qu'on connaissait déjà des anxiolytiques GABAergiques et que les dénominations étaient déjà bien implantées avant cette découverte. Toujours est-il que l'effet anxiolytique des antidépresseurs est réel et souvent très efficace, plus que pour les autres traitements. Ils sont le traitement de première intention à l'heure actuelle en raison de leur profil d'effets secondaires plus intéressant que pour les autres anxiolytiques (pas de dépendance, surtout). Outre l'anxiété stricto sensus, les antidépresseurs sont utilisés dans le traitement des troubles obsessionnels-compulsifs, à des doses supérieures à celles de la dépression.
Il arrive que les sérotoninergiques soient utilisés pour améliorer le sommeil. Par contre, ils ne sont pas des hypnotiques dans le sens où ils ne font pas dormir. Certaines molécules ont la réputation d'être sédatives et d'autres stimulantes, mais rien ne vient corroborer cette affirmation dans la littérature et il y a de bonnes chances que ce ne soit qu'une chimère. Le seul effet notable sur le sommeil des sérotoninergiques est une réduction du sommeil paradoxal assez marquée. Ce qui explique certains effets secondaires de ces médicaments, comme des rêves bizarres ou des cauchemars assez importants. Mais c'est aussi un effet utilisé par les médecins, pour aider à réguler le sommeil dans certaines pathologies où le sommeil paradoxal est déréglé. Les autres indications sont encore assez expérimentales, que ce soit pour le traitement des douleurs chroniques, de l'impulsivité, ou autre.
Les sous-types d'antidépresseurs
[modifier | modifier le wikicode]Les anti-dépresseurs agissent tous sur au moins l'un des trois neurotransmetteurs suivants : la dopamine, la noradrénaline et la sérotonine. Les antidépresseurs les plus couramment utilisés, à l'heure actuelle, agissent uniquement sur la sérotonine, car ils ont moins d'effets secondaires que les autres, et sont plus efficaces que les noradrénergiques ou les dopaminergiques purs. On peut classer les anti-dépresseurs en plusieurs classes, dont les plus connues sont les inhibiteurs de la monoamine-oxydase (IMAO), les tricycliques et les inhibiteurs de la recapture de la sérotonine. On ne sait pas si ces différentes classes ont des différences d'efficacité, mais on a de bonnes raisons de penser que toutes les classes se valent, avec peut-être un effet des IMAO et tricycliques sur les dépressions résistantes aux autres médicaments.


Les inhibiteurs sélectifs de la recapture de la sérotonine inhibent la recapture de la sérotonine. L'adjectif sélectif dans leur nom indique qu'ils n'ont pas ou peu d'effets sur la noradrénaline ou la dopamine, ou tout autre neurotransmetteur, ce qui limite leurs effets secondaires. Les seuls effets secondaires sont limités à des effets secondaires sexuels (impuissance, éjaculation retardée, baisse de libido), neuropsychiatriques et digestifs, si on omet les allergies et intolérances. La molécule la plus connue dans cette classe est la Fluoxétine, vendue autrefois sous le nom de Prozac.
Les inhibiteurs sélectifs de la recapture de la noradrénaline et de la sérotonine, ce qui veut dire qu'ils empêchent la recapture de ces neurotransmetteurs pour recyclage par les neurones. Ils n'agissent pas ou peu sur la recapture de la dopamine et sont donc sélectifs sur la sérotonine et la noradrénaline. Du fait de leur action sur la recapture de la noradrénaline, ils ont plus d'effets secondaires, sans pour autant que leur efficacité sur la dépression soit vraiment probant. Suivant la molécule de utilisée, l'effet sur la recapture sera plus orienté sur la sérotonine ou sur la noradrénaline. Certains tricycliques ont un effet plus fort sur la recapture de la sérotonine, d'autres plus sur la noradrénaline. Par exemple, la duloxetine, la venlafaxine, et la desvenlafaxine ont un effet sérotoninergique plus prononcé, alors que le milnacipran et le levomilnacipran ont un effet noradrénergique plus probant.
Les tricycliques et tétracycliques sont aussi des inhibiteurs de la recapture de la sérotonine et de la noradrénaline, mais ils ne sont pas sélectifs, c'est à dire qu'ils ont aussi une action sur d'autres récepteurs, notamment sur les récepteurs à l'acétylcholine ou encore les récepteurs à l'histamine. Ce qui fait qu'ils ont encore plus d'effets secondaires que les médicaments précédents. Leur nom vient de leur structure moléculaire, qui contient trois à quatre cycles benzéniques. Là encore, suivant la molécule de utilisée, l'effet sur la recapture sera plus orienté sur la sérotonine ou sur la noradrénaline.
Les inhibiteurs de la monoamine-oxydase inhibent le fonctionnement des diverses monoamine-oxydases (pour rappel : des enzymes qui dégradent les monoamines). Leur effet est de saturer les synapses en monoamines, surtout en sérotonine, noradrénaline et sérotonine. Ils peuvent cibler soit la monoamine-oxydase A, soit la monoamine-oxydase B. Ils sont aujourd'hui utilisés en dernière intention, en raison de leurs effets secondaires assez importants. Par exemple, ils interagissent assez mal avec la tyramine, un acide aminé présent dans beaucoup d'aliments. Les patients doivent éviter de consommer du fromage, de l'alcool, du foie et plein d'autres aliments, sous risque de subir une crise hypertensive potentiellement mortelle.
Outre ces trois classes principales, on trouve d'autres médicaments plus rarement utilisés. On peut par exemple citer le bupropion qui est un inhibiteur de la recapture de la dopamine/noradrénaline et quelques autres molécules moins communes qui agissent comme agoniste inverse/antagoniste des récepteurs à la sérotonine. Les dopaminergiques comme le modafinil peuvent encore être prescrits dans certains pays pour soigner la dépression, mais cet usage est très rare et rarement justifié.
Les effets secondaires
[modifier | modifier le wikicode]Les effets secondaires les plus courants sont des troubles bénins et communs : nausées et vomissements, insomnies, fatigue, somnolence, etc. Viennent ensuite les troubles d'ordre sexuels : difficultés d'érection, impuissance, priapisme, etc.
L'arrêt des antidépresseurs peut, bien que ce soit assez peu fréquent, entraîner un syndrome de discontinuation (autrefois appelé à tort "syndrome de sevrage"). Il se manifeste par des symptômes assez variés : nausées, vomissements, diarrhées, petite fièvre, syndrome grippal, insomnie, somnolence, cauchemars, tremblements, vertiges, etc. L'existence de ce syndrome ne signifie PAS que les antidépresseurs sont addictifs ou qu'ils entraînent une tolérance. En réalité, ce syndrome vient du fait que le corps doit s'adapter à une baisse du taux de sérotonine lors de l'arrêt du traitement. Le nombre de récepteurs sérotoninergiques s'adapte assez brutalement, ce qui entraîne quelques symptômes gênants mais rarement graves. On peut éviter l'apparition de ce syndrome en réduisant progressivement les doses, par exemple en les divisant par deux, ou en les diminuant de quelques milligrammes, toutes les deux/trois semaines.
Les antidépresseurs sont aussi connus pour entraîner des épisodes maniaques, surtout chez les patients bipolaires. Les antidépresseurs sont, chez les bipolaires, systématiquement prescrits avec des régulateurs de l'humeur, des médicaments qui calment les états maniaques sans rendre dépressif. Il arrive très rarement (quelques pourcents des patients) que des patients non diagnostiqués bipolaires déclenchent un épisode maniaque sous antidépresseur, souvent au début du traitement. Dans ce cas, cela ne signifie pas forcément que le patient est bipolaire, le diagnostic demandant un épisode maniaque en-dehors de tout traitement médicamenteux, même si c'est quand même mauvais signe. Les patients non-bipolaires qui déclenchent un épisode maniaque sous antidépresseur ont plus de 30% de chances d'évoluer vers un vrai trouble bipolaire. Les psychiatres se battent encore pour savoir si de tels épisodes chez un patient sain signifie ou non la présence d'un trouble bipolaire. Des chercheurs psychiatres supposent que de tels épisodes sont le signe d'une forme atténuée de trouble bipolaire, parfois nommée "trouble bipolaire de type 3", qui se manifeste par des dépressions accompagnées d'épisodes hypomaniaques sous antidépresseurs. D'autres chercheurs pensent que des épisodes induits par des antidépresseurs ne sont que des effets secondaires du traitement, du moins chez la plupart des patients.
Plus rarement, les patients peuvent développer un syndrome sérotoninergique, causé par une overdose de sérotonine, aux symptômes divers. Ce syndrome apparaît presque exclusivement dans le cas d'une interaction médicamenteuse, quand on combine un antidépresseur avec d'autres médicaments sérotoninergiques, les exceptions étant des overdoses franches d'antidépresseurs souvent reliées à des tentatives de suicide. Il se manifeste par des symptômes autant psychiatriques que neurologiques et végétatifs. Les cas peu dangereux se manifestent par de la nausée, des diarrhées, des insomnies, de la nervosité, un comportement légèrement agressif et quelques autres symptômes peu graves. Dans les cas sévères, il peut se manifester par un coma, une confusion ou des délires hallucinatoires, ou de l'épilepsie. Les cas les plus graves se couplent de fièvre, ainsi que de troubles respiratoires et cardiaques. De manière générale, le patient manifeste plusieurs symptômes parmi les suivants, suite à une surdose de sérotoninergiques :
- des symptômes psychiatriques : agitation, hypomanie, hallucinations et/ou délires, confusion, insomnie ;
- des symptômes neurologiques : tremblements, rigidité musculaire, crise épileptique, réflexes plus intenses que d'habitude (hyper-réflexie), défaut de coordination des mouvements (ataxie), akathisie, dilatation des pupilles (mydriase) ;
- des symptômes végétatifs : tachycardie, accélération de la respiration (tachypnée), baisse ou élévation de la pression artérielle, sueurs, fièvre, nausée , diarrhée.
Les dopaminergiques : agonistes et antagonistes de la dopamine
[modifier | modifier le wikicode]Les médicaments dopaminergiques sont assez nombreux, la plupart étant des médicament antagonistes de la dopamine, plus rarement agonistes. On peut aussi citer les antagonistes de la recapture de la dopamine, dont la plupart sont utilisés comme drogues. Mais au-delà de cette utilisation, les dopaminergiques sont aussi utilisés comme anti-parkinsoniens, ou comme anti-psychotiques.
Les stimulants dopaminergiques
[modifier | modifier le wikicode]Les stimulants sont des médicaments qui augmentent la vigilance et favorisent l'éveil. Ils ont généralement une action liée aux neurotransmetteurs impliqués dans l'état d'éveil, à savoir le glutamate, l’acétylcholine et les catécholamines. Ces neurotransmetteurs ont un effet stimulant, qui augmente l'état d'éveil et peut causer des insomnies. De là est venue l'idée d'utiliser des dopaminergiques, des cholinergiques ou des glutaminergiques comme stimulant. Les cholinergiques et les glutaminergiques n'ont pas un effet stimulant vraiment majeur, ce qui fait qu'ils ne sont pas considérés comme des stimulants. Par contre, les médicaments dopaminergiques et noradrénergiques ont un effet bien plus fort. D'ailleurs, l’appellation stimulant est souvent utilisée comme synonyme de "dopaminergique/noradrénergique".
Parmi les stimulants dopaminergiques, les plus utilisés sont les dérivés de la phényléthylamine, des molécules qui comprennent les amphétamines et quelques molécules apparentées. Elles agissent sur les quantités de monoamines cérébrales, avec majoritairement un effet dopaminergique et noradrénergique. Ces stimulants entraînent tous une dépendance assez importante, en raison de leur action dopaminergique qui est source d'addiction. De ce fait, les stimulants sont sévèrement contrôlés et ne sont prescrits que dans des cas bien spécifiques. Ils servent généralement à traiter la narcolepsie ou le trouble déficitaire de l'attention, mais guère plus.
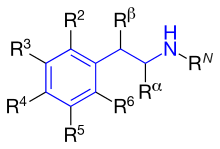
Les plus connues sont l'amphétamine et ses dérivés. Précisons qu'il ne faut pas confondre l'amphétamine et les amphétamines. Derrière cette subtilité se cache le fait que l’amphétamine a de nombreux dérivés, qui ont une structure chimique similaire, mais avec quelques différences. L'amphétamine correspond à une molécule bien précise, illustrée ci-dessous. Par contre, les amphétamines regroupent l'amphétamine proprement dite et ses dérivés. Autrement dit, il ne faut pas confondre la molécule proprement dite avec la classe de molécules dont elle est le parent. Le dérivé d'amphétamine le plus connu est sans doute l'aderall, sans doute car c'est une des rares amphétamines à être encore utilisée dans le milieu médical. Les autres amphétamines sont utilisées comme drogue dures, sous le nom de speed (l'amphétamine proprement dite), de meth (méthamphétamine), etc. Elles agissent en bloquant la recapture de la dopamine et de la noradrénaline pour une courte période (quelques heures, quelques jours).

À part les amphétamines, les phényléthylamines dérivées comprennent le modafinil et la Ritaline (méthylphénidate), des molécules utilisées dans le traitement du trouble déficitaire de l'attention et de l'hypersomnie, notamment la narcolepsie. Elles ont une action dopaminergique et noradrénergique, en bloquant la recapture de la dopamine et de la noradrénaline. Stricto sensus, ce ne sont pas des amphétamines, bien que leur mode d'action soit ressemblant.
Les anti-parkinsoniens
[modifier | modifier le wikicode]La maladie de Parkinson est, sans rentrer dans les détails que nous verrons dans un chapitre dédié au vieillissement du cerveau, une maladie neurologique causée par la mort de neurones dopaminergiques dans une zone bien précise du cerveau appelée la substance noire. Elle est traitée par des traitements symptomatiques, qui compensent le déficit de dopamine dans le cerveau. Si le traitement symptomatique marche relativement bien dans la plupart des cas, tous ces traitements peuvent avoir des effets secondaires assez marqués, causés par un excès de dopamine cérébrale. Les plus communs sont les syndromes psychotiques, caractérisés par des hallucinations et/ou idées délirantes sont notamment communes. Les hallucinations liées à ces traitements sont quasiment toujours des hallucinations visuelles, les idées délirantes sont souvent des idées paranoïaques. Les effets secondaires cardiaques sont aussi à prendre en compte, notamment au niveau de la tension artérielle.
Le médicament de référence est la lévodopa, un précurseur de la dopamine qui est transformé en dopamine dans le cerveau. Cependant, il est rarement utilisé seul du fait de sa "faible" efficacité en mono-thérapie. Il faut dire qu'une bonne partie de la lévodopa est dégradée par la dopa-décarboxylase avant d'atteindre le cerveau. Cela tend à maximiser les effets secondaires (cardiaque, notamment)s, tout en réduisant l'efficacité du traitement sur le cerveau. Pour éviter cela, ce médicament est consommé avec un inhibiteur de la dopa-décarboxylase, ce qui limite la dégradation périphérique, sans agir sur la transformation en dopamine dans le cerveau. Ce traitement est donné en première intention, notamment chez les sujets âgés, qui le supportent mieux.
D'autres traitements sont proposés une fois que la lévodopa commence à perdre en efficacité avec le temps. Ces traitements fonctionnent soit en augmentant la production de dopamine, soit en limitant sa recapture, soit en réduisant sa dégradation. Par exemple, on peut utiliser des médicaments qui réduisent la dégradation de la dopamine en inhibant soit la COMT, soit la monoamine-oxydase. On peut aussi utiliser des agonistes dopaminergiques, comme le modafinil ou des inhibiteurs de recapture de la dopamine.
Les antipsychotiques
[modifier | modifier le wikicode]Les anti-psychotiques ont pour indication principale les états psychotiques, à savoir des états caractérisés par la présence d'au moins un des trois symptômes suivants :
- délire (paranoïa, mégalomanie, érotomanie, autre) ;
- hallucinations (le plus souvent auditives, plus rarement visuelles ou autres) ;
- désorganisation de la pensée et de la parole (le terme technique est : troubles de la pensée formelle).
Les états psychotiques se manifestent dans des maladies diverses, dont la schizophrénie, et sont parfois associé à d'autres symptômes. La maladie psychotique par excellence est la schizophrénie, qui est une psychose de longue durée, mais on pourrait aussi citer des troubles similaires (troubles schizophréniformes, bouffées délirantes aiguës, autres). On observe aussi des psychoses dans certains cas très sévères de dépression (dépression psychotique), ou dans les troubles bipolaires.
Les anti-psychotiques sont aussi utilisés pour traiter les états maniaques des bipolaires. Ces derniers impliquent une humeur élevée (euphorie et/ou irritabilité) et/ou une "hyperactivité", accompagnés d'autres symptômes : accélération de la pensée et de la parole, insomnie massive par réduction des besoins de sommeil, l'apparition de comportements impulsifs ou dangereux, grandiosité pouvant aller jusqu'à un délire mégalomaniaque, ... Leurs indications mineures sont les états d'agitation et d’agressivité, dans le cadre des démences, de l'autisme ou de la psychopathie.
Les anti-psychotiques sont presque tous des antagonistes des récepteurs de la dopamine, avec une affinité toute particulière pour les récepteurs dopaminergiques de type D2. S'ils peuvent aussi agir sur d'autres récepteurs, leur effet sur la manie et les psychoses semblent provenir exclusivement de leur action dopaminergique. En général, leur action sur les récepteurs à la sérotonine ou l'acétylcholine est faible, et dépend de la molécule. Par exemple, certains anti-psychotiques agissent sur les récepteurs de la sérotonine (c'est le cas de la clozapine), mais d'autres ne le font pas.
Leur action anti-dopaminergique est la cause des effets secondaires les plus courants de ces médicaments.
- Le plus classique est un syndrome parkinsonien (tremblements, immobilité, rigidité musculaire) induit par les neuroleptiques, qui recède à l'arrêt du traitement. Il provient de l'action des médicaments sur les ganglions de la base, et notamment sur la substance noire et les autres structures dopaminergiques de ces aires cérébrales. C'est pour cette raison que les neuroleptiques sont contrindiqués chez les parkinsoniens, à l'exception de la dompéridone qui n'entre pas dans le cerveau (elle ne traverse pas la barrière hémato-encéphalique).
- Ces molécules agissent aussi sur les voies dopaminergiques qui innervent l'hypophyse/hypothalamus, deux glandes intracérébrales. L'effet est une augmentation de la production de la prolactine, une hormone impliquée dans le développement des seins et la lactation. Les patients peuvent voir leurs seins pousser, avoir des montées de lait, mais aussi une infertilité et d'autres effets secondaires plus handicapants. À noter que ces effets font que les neuroleptiques sont parfois détournés pour favoriser la lactation chez certaines femmes venant d'avoir un enfant. Cela explique aussi que ces médicaments sont contrindiqués chez les patients qui ont des tumeurs hypophysaires qui secrètent de la prolactine.
- Enfin les effets secondaires cardiovasculaires sont aussi assez fréquents et impliquent de la tachycardie ou de l'hypotension.
- Plus rarement, les patients peuvent développer un épisode catatonique malin (avec dysfonctionnement du système nerveux végétatif), appelé syndrome malin des neuroleptiques.
Les GABAergiques : les mal-nommés anxiolytiques et somnifères
[modifier | modifier le wikicode]Les anxiolytiques GABAergique regroupent les barbituriques, les benzodiazépines ou les non-benzodiazépines. Ils servent à traiter l'anxiété et les troubles du sommeil, mais servent aussi d'anti-épileptiques, de décontractants musculaires, à traiter la catatonie (maligne ou non), le delirium tremens (un syndrome de sevrage à l'alcool extrêmement sévère), etc. Ils ont un effet inhibiteur sur le cerveau, en réduisant son activité électrique générale, ce qui fait que ce sont de très bons anti-épileptiques. Pour certains, ils sont aussi utilisées comme somnifères, ou comme anxiolytiques, parfois les deux à la fois. L'utilisation d'une molécule comme somnifère ou comme anxiolytique/anti-épileptique tient dans la demi-vie, à savoir le temps mis pour réduire de moitié la concentration sanguine du médicament. Plus la demi-vie est courte, plus le médicament est éliminé rapidement du sang et plus son effet est court. Un somnifère aura généralement une demi-vie courte, afin de favoriser l'endormissement sans pour autant entraîner une somnolence diurne (l'effet du médicament doit se dissiper avant le réveil pour cela). Par contre, on attend d'un anxiolytique et d'un anti-épileptique une action prolongée, qui impose une demi-vie assez longue, d'approximativement 24 heures ou plus. Une action prolongée est aussi utile dans les insomnies où le patient se réveille trop tôt dans la matinée.
Ils agissent sur les récepteurs GABA, spécifiquement les récepteurs GABA-A. Contrairement à ce qu'on pourrait penser, ce sont pas des agonistes ou des antagonistes du GABA. La raison à cela est un petit peu subtile. Les récepteurs au GABA sont composés, pour rappel, de plusieurs unités différentes, les principales étant appelées alpha, bêta et gamma. Tous les récepteurs GABA-A se forment en assemblant 5 unités ensemble, les unités n'étant forcément identiques. Un récepteur GABA-A typique est constitué de deux unités alpha, deux unités bêta et une autre unité (généralement gamma, mais pas toujours). Le récepteur a des sites de fixation où les molécules se fixent au récepteur. Il y a un site de fixation du GABA, un site de fixation des barbituriques, un site de fixation des benzodiazépines, un site de fixation de l'éthanol, d'autres pour les neurostéroïdes, etc. Vu que les somnifères et anxiolytiques GABAergiques ne se fixent pas sur le même site que le GABA, ce ne sont pas des agonistes/antagonistes du GABA. Ce sont en réalité des modulateurs allostériques positifs, comme les neurostéroides : lorsqu'ils se fixent sur le récepteur, celui-ci se déforme et cela augmente l'action du GABA sur le récepteur.

Les différentes molécules hypnotiques/anxiolytiques GABAergiques
[modifier | modifier le wikicode]
Les premiers somnifères de cette classe à avoir étés utilisés sont les barbituriques, des dépresseurs du système nerveux central. Ceux-ci ont d'abord été utilisés comme anesthésiants, avant d'être utilisés à plus faibles doses comme sédatifs et anti-convulsivants. Ces médicaments sont dérivés à partir de l'acide barbiturique, dont la structure chimique est illustrée ci-après. Leur action provient de leur sur les récepteurs GABA-A, ainsi que sur les récepteurs AMPA et kainate du glutamate. Ces médicaments ont des effets secondaires très importants, pouvant même être mortels. Le plus important de ces effets secondaires est clairement une dépendance assez importante, qui se manifeste après quelques jours ou semaines d'utilisation. Avec l'invention de somnifères moins dangereux, ceux-ci sont tombés en désuétude pour le traitement des troubles du sommeil.

De nos jours, les barbituriques ont été remplacés par les benzodiazépines. La plupart sont utilisés comme anxiolytiques, car leur demi-vie est assez longue, mais il y a quelques exceptions comme le midazolam dont la demi-vie est trop courte pour cette indication. Ils étaient autrefois utilisés comme somnifères, mais leur demi-vie longue n'aidait pas vraiment, sauf pour les exceptions comme le midazolam. Le fait que ces médicaments entraînent moins d'effets secondaires que les barbituriques font qu'ils sont utilisés en leur lieu et place à l'heure actuelle. Mais ces médicaments sont utilisés pour quelques jours, rarement plus de deux semaines. Il faut dire que ces médicaments entraînent une dépendance après deux à quatre semaines de consommation.
De nouveaux somnifères n'appartiennent pas à cette classe, mais ils ont un effet très similaires. Ils sont appelés des non-benzodiazépines et le zolpidem, le zolpiclone et le zaleplon sont les trois seuls médicaments à faire partie de cette classe. Ces médicaments se distinguent généralement par leur demi-vie (leur durée d'élimination ou de dégradation), qui est très courte, ce qui fait qu'ils utilisent pour les patients qui ont des difficultés d’endormissement. Les effets secondaires sont les mêmes que pour les benzodiazépines.
Les effets secondaires
[modifier | modifier le wikicode]Les effets secondaires de ces médicaments, barbituriques, benzos et autres, sont similaires : somnolence diurne (effet recherché pour le sommeil, mais pénible quand il perdure en journée), amnésie antérograde, dépression respiratoire, effets paradoxaux. Le tout est parfois résumé par l'acronyme HAMAC : Hypnotique, Anxiolytique, Myorelaxant, Amnesiant, anti-Convulsivant. Ils sont à utiliser avec précaution chez les personnes âgées, du fait de leurs effets secondaires et de leur effet sédatif. Ces molécules augmentent le risque de chute, ce qui peut avoir de sérieuses conséquences chez les personnes âgées.
L'effet secondaire le plus dangereux est une modification de la respiration, pouvant aller jusqu’à la dépression respiratoire. C'est la raison pour laquelle les insuffisants respiratoires ne peuvent pas prendre ce genre de médicaments, tout comme les patients atteints d'apnée du sommeil.
L'autre effet secondaire le plus courant est l'amnésie antérograde. Les patients peuvent oublier tout ce qu'ils ont fait durant quelques heures après la prise du médicament.
Certains patients peuvent subir des réactions paradoxales, à savoir des réactions opposées à l'effet sédatif du médicament. Lorsque cela arrive, le traitement peut aggraver l'anxiété et l'insomnie, désinhiber le patient, le stimuler, le rendre agressif ou agité, déclencher des comportements violents, etc. Dans certains cas assez rares, ces traitements peuvent déclencher des épisodes maniaques, voire psychotiques, quand ce n'est pas des déliriums.
Enfin, ces médicaments GABAergiques entraînent aussi une forte dépendance, qui s'installe en quelques jours ou semaines. Quitter un traitement à long-terme par benzodiazépines est par exemple très compliqué. À vrai dire, les mécanismes de cette addiction semblent assez similaires à la dépendance alcoolique. En effet, l'alcool est aussi une molécule GABAergique et il n'est pas étonnant qu'elle ait les mêmes effets que les traitements anxiolytiques : sédation, mais aussi désinhibition, comportement violent et impulsif, addiction et autres. Si un anxiolytique/hypnotique est pris à très forte dose durant longtemps, on peut observer un véritable syndrome de sevrage de type delirium tremens, similaire à celui observé pour l'alcool.
Les bloqueurs des canaux ioniques au sodium
[modifier | modifier le wikicode]Les bloqueurs des canaux ioniques au sodium agissent, comme leur nom l'indique, sur les canaux ioniques. Ils empêchent l'ouverture du canal ionique, ce qui empêche le sodium de rentrer dans les neurones. Cela réduit la fréquence des potentiels d'action, et donc l'activité électrique du cerveau. En conséquence, ils sont utilisés comme médicaments pour traiter l'épilepsie. L'épilepsie est une maladie causée par une activité électrique anormale du cerveau, dont les causes sont assez diverses, mais qui entrainent le plus souvent un dysfonctionnement des canaux ioniques qui rend les neurones plus excitables que la normale. Si les GABA-ergiques ont une activité anti-épileptiques symptomatique, les bloqueurs des canaux ioniques au sodium agissent à la source, directement sur les canaux ioniques.
- Il faut noter que le type d'épilepsie joue beaucoup dans le choix du traitement : certains traitements sont efficaces sur les crises tonico-cloniques mais inefficaces sur les crises atoniques, tandis que d'autres ont une efficacité inverse. Par exemple, il semblerait que l'ethosuximide soit plus efficace que les autres traitements sur les crises d'absences. De même, les crises d'absences sont bien soignées par le valproate de sodium, alors que la carbamazépine les aggrave !
Outre leur action sur l'épilepsie, ces médicaments ont un effet assez important sur les états maniaques des bipolaires, ce qui fait qu'ils sont de plus en plus utilisés chez ces patients, en complément d'un traitement au lithium. Ils sont aussi utilisés dans les traitement des douleurs dites neuropathiques, à savoir d'origine neurologiques.
Les bloqueurs des canaux sodium dérivés du GABA
[modifier | modifier le wikicode]Les gabapentinoïdes sont des molécules dérivées du GABA, mais qui n'ont aucune activité GABAergique (sauf pour quelques exceptions). Elles agissent sur les canaux sodium dépendants du voltage, mais n'agissent pas sur les récepteurs GABA. Elles ne se transforment pas non plus en GABA in vivo, ne participent pas au métabolisme du GABA ou autre. Les plus connues sont la prégabaline, le phenibut, la gabapentine, et quelques autres molécules du même genre.

Les bloqueurs des canaux sodium non-dérivés du GABA
[modifier | modifier le wikicode]
La carbamazépine bloque les canaux ioniques au sodium, mais il aurait d'autres effets sur les canaux potassium et les récepteurs à l'adénosine. Elle est utilisée pour le traitement des épilepsies partielles, ainsi que des crises tonico-cloniques. Elle n'est pas usitée pour les absences et myoclonies, car elle peut exacerber ce type de crises et les rendre plus fréquentes. Elle est utilisée, outre pour l'épilepsie, dans les névralgies trigéminales et le traitement des troubles bipolaires (aussi bien lors des dépressions que des états maniaques). Sa molécule est très similaire aux antidépresseurs tricycliques (imipraminiques), ce qui pourrait expliquer son effet thérapeutique sur les dépressions bipolaires. Cela explique aussi pourquoi la carbamazépine ne doit pas être utilisée en même temps que d'autres anti-dépresseurs. Elle est métabolisée par le foie en un métabolite appelé époxyde, qui a un effet anticonvulsivant mais est assez toxique pour l'organisme. L'oxcarbazépine est une molécule structurellement similaire à la carbamazépine, avec les mêmes effets sur le cerveau. Cependant, elle n'est pas dégradée en époxyde, mais en dihydrocarbamazépine, un métabolite nettement moins toxique.

Le valproate de sodium et ses dérivés (acide valproïque) sont des anti-épileptiques, mais sont aussi efficaces dans les troubles bipolaires, comme la carbamazépine. Il est utilisé dans les épilepsies partielles et dans certaines épilepsies généralisées avec absences et/ou myoclonies. Chimiquement, il s'agit d'un acide gras. Il bloque les canaux sodium, mais a aussi une action sur les récepteurs GABA et NMDA, ainsi que d'autres effets moins connus. Ses effets secondaires sont nombreux, mais celui qui a reçu la plus grande publicité dans le grand public est son effet sur le fœtus : ce médicament entraine des malformations sur les fœtus quand il est consommé par les femmes enceintes.

Les hydrantoïnes sont une classe de molécules anti-convulsivantes qui ont une structure chimique similaire. La phénytoïne est une ancienne molécule, encore utilisée, notamment dans certains cas d'urgence. Il faut dire que cette molécule est éliminée d'une manière non-linéaire, ce qui rend les problèmes de dosages fréquents. Elle bloque, comme les médicaments précédents, les canaux sodium. Des dérivés de la phénytoïne existent, les plus connus étant la méphénytoïne, l'éthotoïne et le phénacémide. Ces dérivés sont moins efficaces que la phénytoïne, mais entraînent moins d'effets secondaires.
Les opioïdes : l'opium et ses dérivés
[modifier | modifier le wikicode]Les médicaments dits opioïdes sont des agonistes des récepteurs opioïdes. Les premiers à avoir été découverts sont la morphine et ses dérivés. Leur nom vient de l'opium, le latex produit par une plante d’Amérique du Sud nommée le pavot somnifère. Ce latex contient de la morphine et de la codéine, deux opioïdes majeurs qui ont été les premiers opioïdes identifiés. D'autres molécules opioïdes ont par la suite été découvertes. Les scientifiques se sont rendu compte que ces molécules avaient les mêmes effets que la morphine et la codéine, avec seulement quelques différences en termes d'efficacité. On a donc donné le nom d’opioïdes aux molécules qui ont le même effet que les dérivés de l'opium (morphine et codéine).
Les différents opioïdes
[modifier | modifier le wikicode]L'agoniste synthétique le plus connu pour les récepteurs opioïdes est de loin la morphine, une puissance anti-douleur. La morphine se lie aux récepteurs mu, mais semble avoir peu d'effets sur les autres récepteurs. Une preuve de ce fait est l'étude des souris chez lesquelles on a désactivé le gène qui code ce récepteur mu. Ces souris deviennent totalement insensibles à la morphine, ce qui prouve qu'elle agit sur ces récepteurs et seulement eux. Par contre, les souris sans récepteurs kappa et delta réagissent normalement à la morphine et ses dérivés.
Depuis la découverte de la morphine, diverses molécules dérivées ont étés inventées. Certaines sont devenues des drogues, comme la cocaïne et l’héroïne, mais d'autres sont devenues des traitements médicamenteux assez importants. Toutes ont des effets similaires à la morphine, avec notamment une action anti-douleur, mais aussi des actions euphorisantes/addictives sans lesquelles certaines ne seraient pas utilisées comme drogue. Ces molécules sont appelées des morphiniques.
Les effets des opioïdes
[modifier | modifier le wikicode]Comme les autres opioïdes, la morphine et les autres morphiniques sont analgésiques, sédatifs et addictifs. L'effet analgésique est de loin le plus utile dans la pratique médicale. Les opioïdes sont aujourd'hui utilisées comme anti-douleur, quand le paracétamol et les anti-inflammatoires ne sont pas assez efficaces. Mais vu leur potentiel addictif, leur utilisation et leur prescription par les médecins est prudente.
Les narcotiques opioïdes ont aussi un effet manifeste sur l'anxiété : qu'il s'agisse de la codéine, de la morphine, du tramadol ou des drogues dérivées, toutes ont un effet anxiolytique. Mais les opioïdes ne sont pas utilisés comme anxiolytiques ou somnifères par les médecins, en raison de leur effet addictif.
L'effet addictif n'est pas leur seul effet indésirable. Ils peuvent entraîner une dépression respiratoire à forte doses, des nausées et vomissement, ainsi que de la constipation. Précisons que ces effets secondaires peuvent être assez graves, surtout la dépression respiratoire. Les overdoses d’opioïdes entraînent une dépression respiratoire très intense, pouvant être fatale. On ne compte plus les morts par arrêt respiratoire causés par une overdose d’opioïdes. Mais ces effets secondaires peuvent être recherchés dans certaines situations. Par exemple, cela permet d'utiliser certains opioïdes comme antitussifs : l'effet sur le centre respiratoire des opioïdes entraîne une réduction de la toux à faible dose. C'est pour cela que l'on utilise la codéine ou le dextrométhorphane comme antitussifs. De même, la constipation induite par les opioïdes permet de les utiliser comme anti-diarrhéique. Précisons que les opioïdes utilisés comme anti-diarrhéique ne rentrent pas dans le cerveau, mais agissent seulement sur le reste du corps (pour les connaisseurs : ils ne traversent pas la barrière hémato-encéphalique).
Tous les opioïdes actuels agissent sur les récepteurs opioïdes de type mu. Pour ce qui est des effets spécifiques aux récepteurs mu, les morphiniques entraînent une euphorie, une contraction musculaire généralisée et une psychose (délires et hallucinations) à fortes doses. L'origine de cet effet délirant/hallucinogène n'est pas très bien connu. L'euphorie induite par les agonistes mu est recherché par les toxicomanes, ce qui fait que de nombreuses drogues sont des dérivés de la morphine.
Les agonistes du récepteur opioïde Kappa ont eux aussi un effet analgésique similaire à celui des autres récepteurs opioïdes, mais entraînent des effets indésirables. Ils entraînent notamment des perturbations du comportement et de l'humeur. Ils ont un effet dépressif, des hallucinations et des délires. Leur effet hallucinatoire est bien plus important que les morphiniques qui agissent seulement sur le récepteur mu. Ils ont donc trop de désavantages par rapport aux alternatives thérapeutiques. De plus, ils induisent une dépression assez intense, une véritable dysphorie. Cet effet, particulièrement désagréable, limite son usage récréatif ou toxicomaniaque.
Les cannabinoïdes : cannabis médical et cannabinoïdes de synthèse
[modifier | modifier le wikicode]Les entreprises pharmaceutiques font actuellement de la recherche sur les agonistes et antagonistes des récepteurs des endocannabinoïdes, pour traiter diverses affections. La plupart de ces produits sont des cannabinoïdes de synthèse. Certains sont présents naturellement dans le cannabis, comme le THC ou le cannabidiol. Leur utilisation médicale est connue sous le nom plus ou moins trompeur de cannabis médical. En général, quand on parle de cannabis médical, on parle de l'utilisation du THC ou du cannabidiol, voire d'un mélange des deux, mais pas d’autre chose.
Les allégations médicales du cannabis thérapeutique sont nombreuses et force est de constater que l’enthousiasme sur le sujet risque d'être la source de beaucoup de désillusions. Selon certains, le cannabis médical serait efficace contre les douleurs chroniques, la dépression, l'anxiété, les troubles du sommeil, la sclérose en plaques, les vomissements liés à la chimiothérapie, et j'en passe. Mais à ce jour, force est de constater que le cannabis médical n'a pas beaucoup d'utilisations médicales confirmées. Seules deux indications sont actuellement confirmées par la FDA américaine : certaines formes rares bien précises d'épilepsie (le syndrome de Dravet et le syndrome de Lennox-Gastaut), et la spasticité liée à la sclérose en plaque (pour laquelle les résultats ne sont pas fameux). Les études quant à leur utilité dans la maladie d'Alzheimer, la sclérose latérale amyotrophiques, les traumas crâniens, les AVC, et d'autres maladies neurologiques, ont été négatives. En somme, le THC et le cannabidiol ne semblent pas servir à grand chose pour le moment, même si la recherche continue.
Outre le cannabis médical, les entreprises pharmaceutiques travaillent sur des médicaments qui agissent sur les récepteurs au cannabinoïdes, mais qui ne sont pas basées sur du THC ou du cannabidiol. Si la plupart de ces molécules sont encore en développement, il faut cependant citer l'exception : le Rimonabant. Ce médicament a été commercialisé en Europe en 2006, avant d'être retiré du marché en 2008. Le Rimonabant était un agoniste inverse des récepteurs cannabinoïdes. Il était utilisé comme médicament anti-obésité, du fait de son effet coupe-faim. Malheureusement, les données de pharmacovigilance ont rapidement montré que ce médicament avait de sérieux effets secondaires psychiatriques. Ils causait de sévères troubles dépressifs et augmentait drastiquement le risque de suicide. Près de 10% des utilisateurs développaient une dépression et le risque de suicide était quant à lui d'environ 1%. Les autorités n'ont pas eu d'autre choix que d'interdire ce médicament une fois les données connues.
Les cannabinoïdes sont censés avoir un effet anxiolytique assez marqué. Précisons cependant que cet effet peut parfois s'inverser. Une minorité de consommateurs développe un syndrome anxieux soudain, qui dure quelques heures à quelques jours, après une prise de cannabis (souvent, la toute première prise). Dans certains cas grave, cela peut carrément évoluer rapidement en un véritable syndrome paranoïaque, voire une psychose franche. Encore une fois, les traitements de ce genre ne sont pas utilisés pour leurs effets secondaires (syndrome d'hyperémèse cannabique, psychoses, paranoïa, confusion mentale, amnésie, ...).
Les adénosinergiques : la caféine et ses dérivés
[modifier | modifier le wikicode]
Les méthylxanthines regroupent la caféine, la paraxanthine, la théobromine et la théophylline. Elles partagent toutes le même squelette moléculaire, illustré ci-contre. Suivant ce qu'on met à la place des radicaux R1, R2 et R3, on obtient soit de la caféine, soit de la paraxanthine, et ainsi de suite. Les radicaux R1, R2 et R3 peuvent contenir soit un atome d'hydrogène, soit un radical méthyl (CH3). Si aucun ne l'est, on obtient de la xanthine, qui n'est pas une méthylxanthine proprement dite car il n'y a aucun groupe méthyl. Si au moins un des radicaux R1, R2 ou R3 est méthylé, alors on obtient une méthylxanthine. La caféine a tous les radicaux méthylés, alors que les cas intermédiaires donnent de la théobromine, de la théophylline et de la paraxanthine.
| Composé | R1 | R2 | R3 |
|---|---|---|---|
| Xanthine | |||
| Xanthine | H | H | H |
| Méthylxanthines | |||
| Théobromine | H | CH3 | CH3 |
| Théophylline | CH3 | CH3 | H |
| Paraxanthine | CH3 | H | CH3 |
| Caféine | CH3 | CH3 | CH3 |
| Xanthine | Théobromine | Théophylline | Paraxanthine | Caféine |
|---|---|---|---|---|

|

|
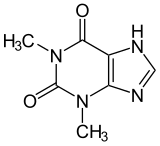
|

|
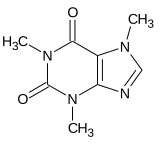
|
Les xanthines et méthylxanthines agissent sur les récepteurs purinergiques, à savoir les récepteurs de l'adénosine. Dans le cerveau, les récepteurs purinergiques les plus courants sont ceux dits de type A1 et A2a. Les deux ont une action inhibitrice, qui réduit le métabolisme et l'activité cérébrale. Les xanthines sont des antagonistes de ces récepteurs, ce qui signifie qu'elles ont un effet inverse à l'adénosine. Là où l'adénosine est sédative, les xanthines et méthylxanthines sont au contraire stimulantes. Leur effet exact sur le cerveau est cependant assez mal connu. SI on sait qu'elles agissent sur les récepteurs purinergiques cérébraux, les conséquences de cette activation sont mal connues. Les chercheurs pensent, sur la base d'arguments expérimentaux, que cette activation causerait une augmentation de la libération de glutamate et de dopamine. Les xanthines seraient donc indirectement dopaminergiques (et glutaminergiques), d'où leur effet stimulant.
La caféine
[modifier | modifier le wikicode]La plus connue est la caféine, qui améliore l'éveil et l'humeur. Chose intéressante, la caféine lutte contre la pression de sommeil. En effet, celle-ci traduit le fait que quelque chose s'accumule dans le cerveau lors de l'éveil, ce quelque chose étant supposé être des substances somnifères. Le candidat idéal pour cette substance est l'adénosine, mais d'autres substances chimiques sont aussi des prétendants à ce titre, comme la prostaglandine D2. Or, la caféine a un effet indirect sur les récepteurs à adénosine, en jouant le rôle d'antagoniste. La caféine ressemble comme deux gouttes d'eau à l'adénosine, et se fixe sur les mêmes récepteurs membranaires : elle empêche l'adénosine d'arriver à bon port et d'avoir son effet somnifère. C'est pour cela que le café est un excitant : il supprime l'action de l'adénosine sur le cerveau.
Précisons que le corps s'habitue à la prise de caféine et y devient de moins en moins sensible, il développe une tolérance à la caféine. La raison est que le nombre de récepteurs à l'adénosine à la surface d'un neurone (ou de toute autre cellule qui exprime ces récepteurs) s'adapte à la demande. Plus on consomme de caféine, plus le nombre de récepteurs augmente. Ce faisant, l'adénosine qui avant ne pouvait pas se lier aux récepteurs bloqués par la caféine peut alors se coller à des récepteurs tous neufs, ce qui réduit l'efficacité de la caféine. C'est tout sauf étonnant, car les récepteurs de l'adénosine sont des récepteurs aux protéines G, qui ont presque tous cette particularité.
