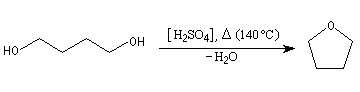Chimie organique/Ethers
Fonction Ether
[modifier | modifier le wikicode]Définition
[modifier | modifier le wikicode]On appelle éther un composé dans lequel un atome d'oxygène est lié par liaisons simples à deux groupes organiques différents
Nomenclature
[modifier | modifier le wikicode]Les éthers simples sont nommés comme des alkoxyalcanes, les ethers cycliques sont nommés comme des oxacycloalcanes:
Synthèse
[modifier | modifier le wikicode]Les éthers sont synthétisés par déshydratation intermoléculaire d'un alcool en présence d'acide sulfurique.
Ether symétriques:
Ether asymétriques:
Polyéthers:
Mécanisme:
En présence d'une base forte, l'alcool est déprotoné en alcoolate qui réagit ensuite avec le carbone élecrophile de l'époxyde. Le produit de la réaction donne un alcoolate d'éther qui peut encore réagir avec une molécule d'époxyde.
Spectroscopie Infrarouge
[modifier | modifier le wikicode]| Vibration | C-O-C (asym) | C-O-C (sym) |
| Nombre d'onde(cm-1) | 1260-1070 | 1055-870 |
| Intensité | (forte) | (forte) |
Groupes Protecteurs
[modifier | modifier le wikicode]Alcool
Du fait de leur faible réactivité, les éthers sont largement utilisés comme groupement protecteur des fonctions alcool et phénol. L'anisole est un éther souvent utilisé pour protéger la fonction phénol lors de réactions sur le cycle benzénique. Il est clivé en phénol et iodure de méthyle, sous l'action de HI, par une réaction de type SN2 qui implique l'atome de carbone du méthyle.
Réactivité des Ethers
[modifier | modifier le wikicode]Réaction Radicalaire
[modifier | modifier le wikicode]La réaction entre l'éther et le dioxygène s'appelle autoxydation. Elle conduit à la formation d'hydroperoxydes (appelés quelquefois "peroxydes d'éther") selon un mécanisme radicalaire en chaîne initié par la lumière. Les hydroperoxydes sont thermodynamiquement instables du fait de la faible énergie de la liaison O-O et cinétiquement labiles. Ils peuvent exploser sous l'action d'une élévation de température, ou d'un choc.
La réaction avec Cl2 de type radicalaire, permet de substituer l'atome d'hydrogène porté par le C en a de l'atome d'oxygène par un atome de chlore.
(Voir composés plurifonctionels)
Sous l'action de bases très fortes comme les organosodiques ou les organolithiens et dans une moindre mesure les organomagnésiens, l'atome d'hydrogène porté par le carbone en b de l'oxygène peut être arraché. Une réaction d'élimination conduit à un alcène et à un alcoolate.
Lorsqu'on chauffe à 200 °C le prop-2-ényloxybenzène (oxyde d'allyle et de phényle), on obtient le 2-(prop-2-ényl)-phénol (orthoallylphénol). La réaction constitue un exemple d'une réaction très générale qui affecte les éthers de vinyle et d'allyle : la transposition de Claisen mise en évidence par Ludwig Claisen (1851-1930).
Les composés plurifonctionnels
[modifier | modifier le wikicode]Les ethers α-halogénés
[modifier | modifier le wikicode]Les α-halogénoéthers sont des composés intéressants car l'atome de chlore est rendu mobile par sa proximité avec l'atome d'oxygène. Il peut être substitué par une assez grande variété de nucléophiles
Exemple: Préparation du 2-hydroxypyrane
Retour Chimie organique