« Neurosciences/Les récepteurs synaptiques » : différence entre les versions
mAucun résumé des modifications |
m →Récepteurs histaminergiques : virgule |
||
| Ligne 49 : | Ligne 49 : | ||
Les antagonistes de l'histamine utilisés pour agir sur le cerveau agissent sur les récepteurs H1, d'où leur nom d''''antihistaminiques H1'''. Comme exemples, on peut citer la doxylamine, la niaprizine, l’alimémazine ou encore la prométhazine. Ils sont utilisés comme anti-naupathiques (contre le mal des transports), anti-émétiques, somnifères et anxiolityques. |
Les antagonistes de l'histamine utilisés pour agir sur le cerveau agissent sur les récepteurs H1, d'où leur nom d''''antihistaminiques H1'''. Comme exemples, on peut citer la doxylamine, la niaprizine, l’alimémazine ou encore la prométhazine. Ils sont utilisés comme anti-naupathiques (contre le mal des transports), anti-émétiques, somnifères et anxiolityques. |
||
* L'effet le plus souvet recherché est anti-naupathique, ce qui explique qu'ils soient utilisés contre le mal des transports. |
* L'effet le plus souvet recherché est anti-naupathique, ce qui explique qu'ils soient utilisés contre le mal des transports. |
||
* Compte tenu de ce qui a été dit dans le paragraphe précédent, on devine qu'ils réduisent la vigilance et induisent une somnolence. Cela explique que de nombreux médicaments contre les vomissements font dormir ou rendent somnolents. Mais peu de médicaments antihistaminiques sont utilisés comme somnifères, et les rares qui le sont sont souvent proposés en traitement de seconde intention. |
* Compte tenu de ce qui a été dit dans le paragraphe précédent, on devine qu'ils réduisent la vigilance et induisent une somnolence. Cela explique que de nombreux médicaments contre les vomissements font dormir ou rendent somnolents. Mais peu de médicaments antihistaminiques sont utilisés comme somnifères, et les rares qui le sont, sont souvent proposés en traitement de seconde intention. |
||
* Ces principes actifs ont aussi un léger effet anxiolytique, plus faible que les benzodiazépines, mais tout de même appréciable. L'anxiolyse modérée qu'ils génèrent est souvent utilisée pour traiter les formes mineures d'anxiété, mais ne rend pas suffisamment service pour soigner les troubles anxieux psychiatriques. Ils peuvent servir, par exemple, à traiter les problèmes d'endormissements liés à une anxiété non-pathologique, à réduire la tension avant un examen, plus rarement comme prémédication avant une anesthésie, ou pour d'autres problèmes du genre. |
* Ces principes actifs ont aussi un léger effet anxiolytique, plus faible que les benzodiazépines, mais tout de même appréciable. L'anxiolyse modérée qu'ils génèrent est souvent utilisée pour traiter les formes mineures d'anxiété, mais ne rend pas suffisamment service pour soigner les troubles anxieux psychiatriques. Ils peuvent servir, par exemple, à traiter les problèmes d'endormissements liés à une anxiété non-pathologique, à réduire la tension avant un examen, plus rarement comme prémédication avant une anesthésie, ou pour d'autres problèmes du genre. |
||
Version du 11 novembre 2018 à 01:46
On a vu il y a quelques chapitres que la majorité des synapses sont des synapses chimiques, qui utilisent des neurotransmetteurs. Ces neurotransmetteurs, une fois libérés dans la synapse, agissent sur des molécules localisées sur la membrane du neurone post-synaptique : les récepteurs synaptiques. Le neurotransmetteur va se lier avec le récepteur, via une liaison chimique. Cette liaison va alors entrainer l'entrée d'ions dans le neurone. Ces récepteurs vont donc agir sur la perméabilité de la membrane neuronale aux ions, laissant passer ceux-ci ou les bloquant suivant leur état. Cela permet de polariser ou de dépolariser la membrane du neurone, facilitant ou empêchant ainsi l’occurrence d'un potentiel d'action.
Tous les neurones n'expriment pas les même récepteurs : certains ont presque exclusivement des récepteurs dopaminergiques, d'autres sont purement sérotoninergiques, d'autres ont un mix de différents récepteurs, etc. Ainsi, certains neurotransmetteurs vont agir sur certaines régions du cerveau, où leurs récepteurs sont nombreux, mais n'auront pas d'effets sur les régions appauvris en leurs récepteurs. Les effets du neurotransmetteur dépendent donc de la localisation des récepteurs. Pour donner un exemple, les neurones sensibles à la dopamine sont localisés surtout dans le centre du vomissement et dans certaines aires motrices. Ainsi, la dopamine et ses agonistes ont une action motrice et émétique. Mais ce n'est pas une propriété du neurotransmetteur, ni de son récepteur : c'est une conséquence de l'activation de certaines aires cérébrales précises. On ne peut donc pas dire que les récepteurs à la dopamine ont une action émétique et motrice, ce qui est un abus de langage courant. Cette nuance comprise, nous allons quand même faire l'abus de langage dans le reste du chapitre, pour simplifier les explications.
Notons que les récepteurs ne sont pas sensibles qu'aux neurotransmetteurs, mais que d'autres molécules semblables au neurotransmetteur peuvent agir sur eux. C'est ainsi que fonctionnent de nombreux médicaments du système nerveux : ils agissent sur des récepteurs de neurotransmetteurs. Suivant le type de récepteur ciblé, l'effet de la molécule sera différent. Si ces sosies activent le récepteur, ils peuvent remplacer la molécule originelle ou du moins simuler son action. On parle alors de molécules agonistes. D'autres substances vont se lier à un récepteur, mais ne vont pas activer celui-ci, qui restera fermé. La substance est alors dite antagoniste. Pour donner un exemple, la cabergoline (un médicament utilisé pour traiter la maladie de Parkinson) active certains récepteurs à la dopamine : on dit que la cabergoline est un agoniste de la dopamine. Plus connue, la caféine est un antagoniste des récepteurs à l'adénosine : elle se fixe sur les récepteurs de l'adénosine, mais les garde inactifs. Comme autre exemple, la naloxone est un antagoniste des récepteurs aux opioïdes, alors que la morphine en est un agoniste.

Les différents types de récepteurs
Les récepteurs peuvent être classés en deux types. Les récepteurs ionotropiques forment une seule molécule avec le canal ionique: la liaison du neurotransmetteur modifie la forme du récepteur, qui s'ouvre et laisse passer un ion spécifique. Ces récepteurs ont pour particularité d'être très rapides, la fixation du neurotransmetteur ouvrant directement le canal ionique. Ils sont utilisés pour des réactions demandant des temps très faibles, de l'ordre de la milliseconde, rarement plus de la seconde. Ces récepteurs ionotropiques sont à comparer aux récepteurs métabotropes, des récepteurs sans canal ionique intégré, qui utilisent un intermédiaire chimique pour activer le canal ionique. Dans les grandes lignes, la fixation du neurotransmetteur sur le récepteur modifie la conformation de celui-ci. Sous cette nouvelle forme, il va libérer une molécule intermédiaire dans le cytosol de la cellule, qui va se déplacer jusqu’au canal ionique. L'intermédiaire va se lier au canal ionique et l'ouvrir. En conséquence, ces récepteurs sont relativement lents, dans le sens où ils mettent du temps à réagir à la fixation d'un neurotransmetteur. Ils sont utilisés pour des réactions relativement lentes, de l'ordre de la seconde au minimum, de l'heure ou de la journée pour les plus lents. En contrepartie, l'intermédiaire chimique peut non seulement ouvrir un canal ionique, mais aussi modifier l'expression des gènes du neurone, ou modifier leur métabolisme. Ils ont donc une action plus versatile que les récepteurs ionotropes.
 |
 |
Récepteurs aux protéines G
Les récepteurs métabotropes utilisent tous un intermédiaire de la classe des protéines G, d'où leur nom de récepteurs liés aux protéines G. Les récepteurs eux-mêmes sont le plus souvent des protéines, les exceptions étant rares. Ces récepteurs sont intégrés à la membrane du neurone, qu'elles traversent en plusieurs endroits, en faisant un trajet relativement sinueux. Tous les récepteurs traversent la membrane en 7 endroits, formant 7 hélices transmembranaires. Celles-ci sont reliées avec 3 ponts situés au-dessus de la membrane et 3 ponts chimiques situées dans la cellule, sous la membrane. La portion exposée à l'environnement est celle qui se lie aux neurotransmetteurs, celle à l'intérieur permettant au récepteur de transmettre le signal du neurotransmetteur à l'intérieur de la cellule.

Ces récepteurs couplés aux protéines G sont classés en différents types, suivant le lieu de fixation des neurotransmetteurs et la méthode de liaison. Dans les grandes lignes, il existe trois classes principales, qui portent les noms de classe A, B et C. Les récepteurs de la classe A comprennent les récepteurs aux catécholamines, ainsi que des récepteurs olfactifs ou sensibles à la lumière (présents dans la rétine). Le récepteur le plus typique de cette classe est sans conteste la rhodopsine, une molécule qui capte la lumière dans la rétine.

Ces récepteurs sont reliés à des protéines G, appelées ainsi parce que leur activation fait intervenir de la guanosine triphosphate (GTP) ou diphosphate (GDP). Ces protéines G sont composées de trois unités, nommées Gamma, Alpha et Bêta. Les sous-unités Gamma et Bêta sont fortement liées entre elles, formant une sorte de tout dont l'unité Alpha peut se détacher dans certaines conditions. Elles peuvent se lier soit à du GDP, soit à du GTP. Au repos, quand le récepteur n'est pas lié à un neurotransmetteur, l'unité Alpha est liée à une molécule de GDP. L'activation des protéines G se produit quand le neurotransmetteur se lie au récepteur. La liaison du récepteur avec un neurotransmetteur va modifier la conformation de la protéine G. Celle-ci va alors libérer le GDP de l'unité Alpha pour le remplacer par du GTP. L'unité Alpha va alors se détacher et va alors soit servir d'intermédiaire de transmission, soit déclencher une cascade de réactions chimiques dans le neurone. Par la suite, un groupement phosphate va se détacher du GTP, transformant celui-ci en GDP. L'ensemble unité Alpha-GDP va lors se fixer sur une protéine G à laquelle il manque un groupement Alpha, la boucle est bouclée.
 |
 |
Pendant son voyage dans le cytoplasme, la protéine Alpha-GTP va interagir avec d'autres molécules. Dans le cas le plus simple, elle va se fixer directement au canal ionique et l'ouvrir. Mais ce cas est extrêmement rare. Dans la majorité des cas, la molécule Alpha-GTP va interagir avec un second intermédiaire, appelé second messager. Il s'agit soit d’adénylate cyclase, soit de phospholipase C. Dans le premier cas, l'Alpha-GTP va se fixer sur l'adénylate cyclase, ce qui va l'activer. Une fois activée, l'adénylate cyclase va catalyser la transformation d'ATP en AMP cyclique. Cet AMP cyclique va alors entrainer diverses cascades de réactions chimiques agissant sur l'expression des gènes dans le neurone. Dans le second cas, l'Alpha-GTP va se fixer sur la phospholipase C, qui se décomposera alors en inositol-triphosphate (IP3) et en diacylglycérol (DAG). Ces deux molécules vont agir sur des protéines kinase, qui faciliteront l'ouverture de canaux ioniques.

Récepteurs aux monoamines
Les mono-amines ont chacune un récepteur dédié. Ainsi, on trouve différents récepteurs pour l'histamine, la dopamine, la sérotonine, ou la noradrénaline.
Récepteurs histaminergiques

Il existe plusieurs récepteurs à l'histamine, nommés récepteurs H1, H2, H3 et H4, et l'existence de récepteurs pour la recapture est supposée. Seuls les récepteurs H1 et H3, deux récepteurs métabotropes, sont présents dans le cerveau. Ils sont présents sur des neurones différents, certains neurones exprimant beaucoup plus de récepteurs H1 que H3, d'autres faisant l'inverse. L'action des récepteurs H1 semble être liée à l'état de veille : ils stimulent l'éveil et améliorent la vigilance. Cette action a de nombreux effets annexes, comme une réduction de l'anxiété et de la nervosité. Le rôle des récepteurs H3 est encore mal connu, mais semble inhiber la libération des monoamines et de l'acétylcholine. Mais leur fonction exacte est encore mal connue.
Les antagonistes de l'histamine utilisés pour agir sur le cerveau agissent sur les récepteurs H1, d'où leur nom d'antihistaminiques H1. Comme exemples, on peut citer la doxylamine, la niaprizine, l’alimémazine ou encore la prométhazine. Ils sont utilisés comme anti-naupathiques (contre le mal des transports), anti-émétiques, somnifères et anxiolityques.
- L'effet le plus souvet recherché est anti-naupathique, ce qui explique qu'ils soient utilisés contre le mal des transports.
- Compte tenu de ce qui a été dit dans le paragraphe précédent, on devine qu'ils réduisent la vigilance et induisent une somnolence. Cela explique que de nombreux médicaments contre les vomissements font dormir ou rendent somnolents. Mais peu de médicaments antihistaminiques sont utilisés comme somnifères, et les rares qui le sont, sont souvent proposés en traitement de seconde intention.
- Ces principes actifs ont aussi un léger effet anxiolytique, plus faible que les benzodiazépines, mais tout de même appréciable. L'anxiolyse modérée qu'ils génèrent est souvent utilisée pour traiter les formes mineures d'anxiété, mais ne rend pas suffisamment service pour soigner les troubles anxieux psychiatriques. Ils peuvent servir, par exemple, à traiter les problèmes d'endormissements liés à une anxiété non-pathologique, à réduire la tension avant un examen, plus rarement comme prémédication avant une anesthésie, ou pour d'autres problèmes du genre.
Récepteurs dopaminergiques
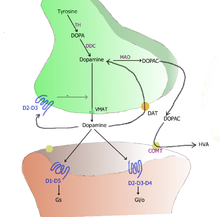
Il existe 5 types de récepteurs à la dopamine, nommés récepteurs D1, D2, D3, D4 et D5. Tous sont métabotropes. Ils sont classés en deux types : D1 et D2. La classe des récepteurs D1 comprend le récepteur D1 et D5, alors que les récepteurs de type D2 comprennent les récepteurs D2, D3 et D4. Il faut aussi noter que les neurones peuvent recycler la dopamine qu'ils émettent. Ils disposent pour cela d'un récepteur de recapture, qui récupère la dopamine présente dans la synapse. La dopamine captée par ce transporteur est alors recyclée, soit en étant brisées en molécules élémentaires, soit en étant réincorporée dans des vésicules synaptiques. Ce récepteur, appelé récepteur de recapture de la dopamine, ou DAT, est impliqué dans diverses maladies. Certains médicaments, les inhibiteurs de la recapture de la dopamine, empêchent ce récepteur de fonctionner. La dopamine ne pouvant être recapturée, le taux de dopamine augmente dans les synapses. Cela permet de signer des maladies causées par un manque de dopamine dans les synapses, comme la maladie de Parkinson.
Les récepteurs dopaminergiques sont sensibles à la dopamine, ainsi qu'à divers agonistes. Les agonistes dopaminergiques sont assez divers, mais ils ont tous les mêmes effets : élévation de l'humeur pouvant aller jusuq'à l'euphorie, augmentation de l'activité (hyperactivité), accélération motrice et psychique, amélioration de la vigilance, réduction de la fatigue et des besoins de sommeil, amélioration de la confiance en soi, désinhibition et impulsivité, parfois agressivité ou irritabilité, coupent l'appétit, etc. Ces effets sont d'ailleurs assez similaires aux symptômes des états maniaques observés chez les bipolaires, ce qui traduirait une altération dopaminergique chez ces patients. A fortes doses, les entrainent des symptômes psychotiques : délires, hallucinations, désorganisation de la pensée et du comportement. A l'exception des symptômes psychotiques, ces effets peuvent aussi être utilisés en thérapeutique, mais aussi à des fins bien moins recommandables.
- Ils sont utilisés pour traiter la maladie de Parkinson, qui est causée par un déficit en dopamine dans certaines aires cérébrales. L'effet recherché est alors la stimulation psychomotrice.
- Ils servent de traitement d'appoint pour la narcolepsie, en raison de leur effet excitant. Ils améliorent l'état d'éveil de ces patients, ce qui les empêche de s’endormir spontanément.
- En psychiatrie, ils sont utilisés pour soigner le trouble déficitaire de l'attention, ou TDAH, un trouble caractérisé par une hyperactivité, une inattention et de l'impulsivité. Les agonistes dopaminergiques ont tendance à améliorer l'attention de ces patients, à calmer leur agitation et à réduire leur activité, alors qu'ils ont l'effet inverse chez les sujets sains ! Leur effet dans le TDAH fait penser à certains que ces médicaments améliorent l'attention et auraient un effet pro-cognitif, mais rien n'est plus faux. Les études ont montrée qu'ils n'entrainaient pas d'augmentation de performance chez les sujets sains et pouvaient même réduire les performances chez certains sujets... Le traitement le plus donné dans cette indication est la ritaline, avec des modalités de prescription différentes selon les pays.
- Beaucoup plus rarement, ils sont utilisés comme antidépresseur, soit en seconde intention, soit en complément d'un traitement sérotoninergique. L'effet recherché est alors une élévation de l'humeur et de l'activité, ainsi que la stimulation psychomotrice et l'augmentation de la confiance en soi. Ils soignent alors l'anhédonie et le ralentissement psychomoteur chez les patients atteints, dans certaines formes de dépression. Comme exemple, on pourrait citer la ritaline/le modafinil, dont les indications officielles comprennent la dépression majeure. Mais le point suivant explique qu'ils ne soient que très rarement utilisés.
- Tous, sans exception, ont un potentiel addictif majeur, ce qui explique que certains soient utilisés comme drogues. Formellement, la cocaïne et l’héroïne ont un effet dopaminergique avéré qui explique leur caractère addictif destructeur. On peut aussi citer les amphétamines, qui inhibent la recapture de la dopamine et de la noradrénaline, en plus de stimuler la libération de dopamine.
- Plus rarement, ils sont utilisés comme coupe-faim, afin de diminuer l'obésité. C'était notamment le cas du malheureusement connu médiator, un dérivé d'une amphétamine à l'effet anorexigène.
- Ils ont aussi un effet émétique, à savoir qu'ils font vomir.
A l'inverse, il existe aussi des antagonistes de la dopamine, qui empêchent la dopamine d'agir sur les récepteurs. Ces antagonistes ont des utilisations thérapeutiques en psychiatrie, mais aussi en gastroentérologie !
- En psychiatrie, ils sont utilisés pour leur effet anti-psychotique/neuroleptique, à savoir qu'ils calment les délires, hallucinations et symptômes de désorganisation. Cette triade de symptôme est caractéristique des troubles psychotiques, à savoir la schizophrénie et les troubles délirants. Les neuroleptiques sont les traitements de choix pour ces maladies, qu'ils sont les seuls à soigner. La découverte de ces principes actifs a été une révolution dans le domaine de la psychiatrie, permettant à des patients de recevoir enfin des soins dignes de ce nom et de quitter les asiles où ils restaient parfois enfermés en attendant une éventuelle rémission... Tous les neuroleptiques sont supposés agir sur les récepteurs D2, qui seraient suractivés dans la schizophrénie et les troubles délirants.
- Ils sont aussi utilisés pour leur effet anti-émétique. La plupart des anti-vomitifs disponibles en pharmacie sont d'ailleurs des neuroleptiques dits cachés. C'est le cas de la dompéridone (motillium), du primperan, du vogalène, et de bien d'autres encore. Leur effet est lié à la présence de récepteurs dopaminergiques dans le centre du vomissement, l'aire cérébrale chargée de ce réflexe digestif.
Récepteurs adrénergiques


Noradrénaline et la noradrénaline se fixent aux mêmes récepteurs adrénergiques, ce qui explique que les deux ont plus ou moins le même effet sur les neurones. Ils sont au nombre de cinq et se regroupent dans deux classes aux doux noms de récepteurs alpha et récepteurs bêta. On distingue ainsi les récepteurs , , , et . Tous ne sont pas présents dans le cerveau, ou du moins pas en nombre suffisant pour avoir un effet notable. Là encore, on trouve de plus un récepteur de recapture, appelé NET.
Les médicaments qui agissent sur des récepteurs sont nombreux. Les antagonistes de la noradrénaline portent le nom de bêta-bloquants et sont souvent utilisés pour traiter les problèmes cardiaques (le cœur étant rempli de récepteurs adrénergiques). Leur utilisation en psychiatrie ou en neurologie est beaucoup plus rare et aucune indication fiable n'est à l'ordre du jour. Cependant, ils pourraient réduire l'anxiété et calmer l'agitation, ce qui pourrait en faire des anxiolytiques, s'ils n'avaient pas d'effets cardiaques aussi importants. Ils peuvent aussi perturber la mémorisation des émotions intenses, la noradrénaline ayant un grand rôle dans la mémorisation émotionnelle. Cet effet, ajouté à l'anxiolyse, pourrait permettre de traiter les troubles anxieux traumatiques, comme le syndrome de stress post-traumatique, mais rien n'est moins sûr à l'heure actuelle.
D'autres noradrénergiques agissent sur le récepteur de recapture DET, d'où leur nom d'inhibiteur de la recapture de la noradrénaline (IRN). Ils sont utilisés comme traitement pour la dépression. Le tout premier traitement antidépresseur était d'ailleurs un inhibiteur de la recapture de la noradrénaline appelé réboxétine. Il fût découvert par hasard, suite à des essais cliniques comme traitement dans d'autres indications et a été le premier antidépresseur commercialisé. Les IRN sont utilisés comme traitement contre la dépression, mais sont parfois utilisés hors-indication officielle contre les troubles anxieux lourds. Mais leur effet réel est loin d'être connu, même s'il semblerait que leur efficacité contre la dépression soit au mieux faible, voire totalement inefficaces. Si l'on ajoute à cela les lourds effets secondaires, notamment cardiaques, on comprend pourquoi il s'agit d'une classe d'antidépresseurs très peu utilisée.
Récepteurs sérotoninergiques

Les récepteurs à la sérotonine sont présents à des degrés divers dans diverses zones du cerveau et du reste du corps. Ils sont au nombre de 13 et sont classés en 7 types qui portent les noms de récepteurs 5-HT1, 5-HT2, 5-HT3, 5-HT4, 5-HT5, 5-HT6 et 5-HT7. Leur nombre de 13 récepteurs différents s'explique par le fait que les récepteurs 5-HT1 et 5HT2 possèdent plusieurs sous-types, respectivement appelés récepteurs 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F et 5-HT2A, 5-HT2B, 5-HT2C. A l'exception du récepteur 5-HT3, tous sont des récepteurs métabotropes. Ceux-ci ont des effets très divers, certaines facilitant l'entrée de potassium dans la cellule, tandis que d'autres en facilitent la sortie. Seul le récepteur 5-HT3, ionotrope, a un rôle clair : il facilite l'entrée de calcium et de potassium dans la cellule.
Ces différents types de récepteurs sont répartis dans le cerveau, certaines aires étant riches en un type de récepteurs et pauvre en d'autres. Par exemple, certaines aires cérébrales sont riches en récepteurs 5HT3, mais pauvres en autres récepteurs. La conséquence est que les agonistes/antagonistes de chaque type de récepteur ont des effets neurologiques ou psychiatriques différents. Par exemple, les antagonistes du récepteur 5HT3 vont surtout agir sur les aires cérébrales du vomissement, mais assez peu sur les aires liées à la cognition ou la perception. Ils font de bons antiémétiques, mais n'ont pas d'autre effet neuropsychiatriques notables. Par contre, les agonistes des récepteurs 5HT2A activent le cortex visuel et les aires liées à la cognition. Leur effet principal est avant tout délirant et hallucinogène, mais ils ont aussi un effet euphorisant assez marqué. Le LSD est justement un antagoniste des récepteurs 5HT2A, ce qui explique le fait qu'il entraine des troubles de la perception, de l'euphorie, ainsi que des délires et expériences hallucinations.

Là encore, on trouve des récepteurs pour la recapture de la sérotonine, qui captent la sérotonine relarguée dans la synapse pour la recycler. Ceux-ci sont appelés les récepteurs SERT. Encore une fois, comme avec la dopamine, il existe des médicaments qui bloquent ce transporteur, afin d'augmenter le taux de sérotonine intra-synaptique. Ces médicaments, les inhibiteurs sélectifs de la recapture de la sérotonine, sont utilisés pour soigner la dépression, l'anxiété et les troubles obsessionnels-compulsifs.
Récepteurs mélatoninergiques
Il existe plusieurs récepteurs à la mélatonine, qui sont classés en trois : les récepteurs MT1, MT2 et MT3. Les récepteurs MT1 et MT3 sont exprimés dans le cerveau, alors que le MT2 est présent uniquement dans la rétine. Le récepteur MT3 n'est présent que chez certains animaux, mais est absent chez les mammifères.
Récepteurs aux acides aminés
Les récepteurs au glutamate et au GABA sont relativement similaires, malgré de nombreuses différences. Dans ce qui va suivre, nous allons voir les récepteurs du glutamate et du GABA. Il faut cependant noter que ceux-ci sont certes spécialisés, mais peuvent réagir à d'autres molécules que le glutamate et le GABA. Par exemple, certains récepteurs au glutamate vont se lier non seulement au glutamate, mais aussi à la glycine ou à la molécule de NMDA.
Récepteurs du glutamate

Les récepteurs du glutamate sont assez nombreux, certains étant ionotropes et d'autres des récepteurs couplés aux protéines G. Trois d'entre eux sont des récepteurs ionotropes : les récepteurs NMDA, kaïnate et AMPA. Il n'y a pas de récepteurs de recapture du glutamate, mais certains récepteurs peuvent capter la glutamine, un précurseur du glutamate. Les cellules gliales peuvent dégrader le glutamate en glutamine, avant de larguer celle-ci dans le milieu extérieur, facilitant de fait un recyclage indirect du glutamate par les neurones.
La majorité des synapses glutamatergiques possèdent à la fois des récepteurs NMDA et AMPA. Cependant, quelques synapses ne possèdent que des récepteurs NMDA, mais pas de récepteurs AMPA. Ces synapses ont la particularité d'être inactives dans des conditions physiologiques normales, d'où leur nom de synapse silencieuse. Ces synapses sont très courantes lors du développement du cerveau, et peuvent être vue comme des synapses immatures. La plupart disparaissent au cours du développement, des récepteurs AMPA apparaissant rapidement dans de telles synapses. Il reste cependant quelques synapses de ce type dans le cerveau adulte, dans une aire cérébrale appelée l'hippocampe. Elles auraient un rôle à jouer dans la mémorisation, mais rien de bien certain à l'heure actuelle.

Les récepteurs kaïnate et récepteurs AMPA sont sensibles au glutamate. Les premiers sont aussi à d'autres molécules, principalement le kaïnate (d'où leur nom). Les seconds sont sensibles à la molécule d'AMPA. Ce sont des récepteurs ionotropes perméables au sodium et au potassium.
Récepteur NMDA

Le récepteur NMDA est un récepteur ionotrope activé par le glutamate, la glycine et la molécule de NMDA. Leur canal ionique laisse passer en priorité l'ion calcium, ainsi que les ions potassium et sodium, dans une moindre mesure. Ces ions étant chargés positivement, l’ouverture de ces canaux entraine naturellement une augmentation du potentiel membranaire. Ces récepteurs ont donc un effet excitateur, comme nous l'avions déjà dit dans le chapitre précédent, quand nous avions abordé le glutamate. Il s'agit de récepteurs qui, une fois ouvert, permettent de polariser le neurone (ce qui explique que le glutamate soit un neurotransmetteur excitateur). Le fait que ceux-ci laissent entrer le calcium dans la cellule explique le fait que le glutamate soit excito-toxique à forte dose. En effet, le calcium est un poison pour les cellules, à forte dose. Une sur-activation des récepteurs NMDA permet à de fortes doses de calcium de rentrer dans la cellule, d'où un effet toxique sur les neurones.
Il faut noter que le glutamate et la glycine ne se lient pas au récepteur au même endroit, mais à des zones différentes de la molécule du récepteur. La première zone permet à une molécule de glutamate de se lier au récepteur. La molécule de glycine peut se lier sur un second site. Un troisième site permet de fermer le pore, même si les deux autres sites sont effectivement occupés par du glutamate ou de la glycine. Il faut préciser que le pore peut parfois être bloqué par une molécule, empêchant le récepteur de fonctionner. Généralement, les récepteurs NMDA sont occupés par un ion magnésium, qui bloque le pore. Le récepteur NMDA ne peut s'ouvrir que si l'ion magnésium est dégagé du pore, ce qui n'arrive que quand le neurone est suffisamment dépolarisé.
Récepteurs du GABA
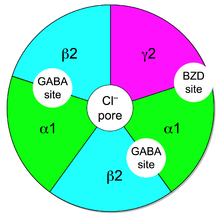
Le GABA peut agir sur deux récepteurs, qui portent le nom de récepteur GABA-A et GABA-B. Les premiers sont ionotropes, tandis que les seconds sont métabotropes. Le récepteur GABA-A est un récepteur qui laisse passer les ions chlore. Dans le cerveau d'un adulte, ce récepteur permet l'entrée de chlore dans la cellule, ce qui l'hyperpolarise, d'où le caractère inhibiteur du GABA. Mais dans le cerveau en développement, les neurones sont plus chargés en chlore que le milieu extérieur : le récepteur va permettre la sortie du chlore des neurones, ce qui entraine un effet excitateur ! Ce récepteur est notamment la cible de l'alcool (l'éthanol, pour être précis), ainsi de divers somnifères. Les benzodiazépines et barbituriques (des somnifères) interagissent fortement avec ce récepteur, d'où leur effet somnifère.
Ce récepteur est une molécule qui se décompose en 6 unités, appelées alpha, bêta, delta, gamma, pi et thêta. Il existe différents types de récepteurs au GABA, qui se différencient par les unités présentes et leur conformation. Chaque sous-unité est sensible à des molécules diverses, certaines étant le lieu de fixation du GABA, d'autre le lieu de fixation des barbituriques, d'autres le lieu de fixation des benzodiazépines, et d'autres le lieu de fixation de l'éthanol.

Il faut noter que certains neurones possèdent un récepteur de recapture du GABA. De plus, le GABA étant dérivé du glutamate, les mécanismes de recyclage du glutamate permettent aussi de recycler le GABA. A noter que les cellules gliales peuvent dégrader le GABA en glutamine.
 |
 |
Récepteurs à l'acétylcholine

L'acétylcholine peut se lier à deux types de récepteurs : les récepteurs muscariniques et nicotiniques. Les récepteurs nicotiniques sont des récepteurs ionotropes, perméable aux ions sodium et potassium. Ils sont sensibles aussi bien à l'acétylcholine et à la nicotine (d'où leur nom). Le curare est un antagoniste de ce récepteur. Ces récepteurs sont divisés en 5 sous-unités, le tout ayant une structure semblable aux récepteurs GABA-A. En comparaison, les récepteurs muscariniques sont des récepteurs métabotropes, sensible aussi bien à l'acétylcholine qu'à la muscarine (d'où leur nom), liés à un canal ionique perméable au potassium. Il en existe 5 types connus à l'heure actuelle, qui sont appelés les récepteurs M1, M2, M3, M4 et M5. Il n'y a pas de récepteurs pour la recapture de l'acétylcholine proprement dite. Cependant, les récepteurs CT peuvent recapturer la choline, un précurseur de l'acétylcholine.
Récepteurs muscariniques
Les récepteurs muscariniques sont sensibles à différents agonistes ou antagonistes. La muscarine est le premier agoniste identifié par les scientifiques ce qui explique le nom donné au récepteur. Celle-ci agit majoritairement sur le système nerveux périphérique (elle ne traverse pas la barrière hémato-encéphalique à de faibles concentrations), pas trop sur le système nerveux central. Elle entraine une hyper-salivation, une augmentation des sécrétions lacrymales, une hyper-sudation, vomissements et diarrhées, augmentation des urines, sur-sécrétion gastrique, etc. On peut résumer ses effets sur le système périphérique par une hypersécrétion, que ce soit pour les larmes, le suc gastrique, l'urine, la transpiration et bien d'autres. A de plus fortes doses, elle agit sur le cerveau, ce qui peut entrainer une fièvre, des tremblements et des convulsions.
Récepteurs nicotiniques

Le récepteur nicotinique est composé, comme les récepteurs muscariniques, de cinq unités disposées en cercle autour du pore central. Dans le récepteur nicotinique, on trouve quatre unités différentes, dont une est en double. Elles portent les noms d'unités alpha, beta, delta et epsilon, l'unité alpha étant en double. La molécule d'acétylcholine se lie aux deux unités alpha, à raison d'une molécule par unité : il faut donc que deux molécules d'acétylcholine se lient au récepteur pour que le pore s'ouvre. Cela explique que le récepteur soit assez peu sensible, dans le sens où il faut que la concentration en acétylcholine dans la synapse soit très forte pour qu'il s'ouvre. Outre l'acétylcholine, les récepteurs nicotiniques réagissent à d'autres molécules : la nicotine et le curare sont les plus communs. Là où la nicotine est un agoniste du récepteur, le curare en est un antagoniste.
Le curare n'agit que sur les muscles, vu qu'il ne peut pas atteindre le cerveau (en termes techniques, il ne peut pas traverser la barrière hématoencéphalique). L'effet du curare est un relâchement musculaire, les muscles ayant alors des difficultés à se contracter. Cela peut aller jusqu'à une paralysie complète. Cette paralysie musculaire entraine, à fortes doses, un arrêt des muscles respiratoires, ce qui peut entrainer la mort. Cet effet de paralysie est parfois recherché. En effet, le curare (ou du moins des molécules dérivées) est utilisé lors des anesthésies générales, afin de décontracter totalement les muscles pour faciliter une chirurgie quelconque. Évidemment, cette anesthésie par le curare est complétée par une assistance respiratoire, pour compenser l'arrêt respiratoire.
La nicotine, au contraire d curare, agit aussi bien sur le cerveau que sur les autres organes. Les neurones sensibles à la nicotine sont essentiellement des neurones dopaminergiques, impliqués dans ce qu'on appelle le système de récompense(on l'abordera dans un chapitre ultérieur). Dans les grandes lignes, la nicotine induit une production supplémentaire de dopamine. L'effet est donc une légère euphorie, couplée à une sensation de plaisir. Un autre effet à court-terme sur le cerveau est son effet stimulant : il améliore la concentration et l'attention, du moins sur le court-terme. A plus long-terme, elle entraine une dépendance, en lien avec son action sur les neurones dopaminergiques.
Récepteurs opioïdes
Les récepteurs opioïdes sont sensibles aux substances opioïdes, qu'elles soient endogènes ou artificielles. Il existe plusieurs récepteurs opioïdes, les scientifiques ayant surtout étudiés les trois récepteurs métabotropes , et . Deux autres récepteurs, nommés zêta et récepteur à la nociceptine ont été identifiés, mais leur fonction et leur structure est moins bien connue.
Les trois récepteurs , et sont chacun codés par un seul gène, qui portent les noms de MOR pour mu, DOR pour delta et KOR pour kappa. L'étude des récepteurs opioïdes a fait de nombreux progrès une fois les trois gènes MOR, DOR et KOR découverts. Les scientifiques ont notamment réussi à désactiver ces gènes sur des souris génétiquement modifiées, ce qui a permis d'étudier la manière dont elles réagissent aux opioïdes exogènes ou endogènes. Grâce à ces études, on sait que chaque récepteur est activé par certains peptides opioïdes, mais pas tous. Par exemple, la morphine agit surtout sur les récepteurs mu, mais pas sur les récepteurs delta et kappa.
| Récepteurs | Mu | Delta | Kappa | Nocip |
|---|---|---|---|---|
| Enképhalines | X | X | ||
| Endorphines | X | |||
| Endomorphines | X | |||
| Dynorphines | X | |||
| Nociceptine | X |
Les récepteurs opioïdes sont tous inhibiteurs, leur action entrainant une réduction de l'activité du neurone. Ils ont tous une action analgésique, avec quelques actions annexes qui vont d'un effet anxiolytique à une action euphorisante, en passant par une addiction, selon les récepteurs. Les effets sont communs à tous les opioïdes.
- Leur utilisation médicale la plus connue est de loin l'effet contre la douleur, l'analgésie. Les opioïdes sont utilisés pour lutter contre les douleurs chroniques ou très intenses. Cette action serait causée par son action au niveau du cerveau, dans les aires cérébrales de la perception de la douleur, aussi à une action au niveau de la transmission nociceptive dans la moelle épinière. Non seulement la douleur serait moins bien transmise, mais elle serait aussi atténuée par le cerveau.
- Les opioïdes ont aussi un effet anxiolytique et sédatif manifeste. Autrefois, les opioïdes étaient utilisés pour calmer certaines formes d'anxiété et les troubles anxieux invalidants. Mais ce n'est plus le cas de nos jours, vu que les psychiatres disposent de médicament bien plus sûrs, au potentiel addictif plus faible (benzodiazépines) voire nul (antidépresseurs), avec des effets secondaires moins dangereux.
- Ils ont aussi un effet euphorisant, recherché par les toxicomanes. L'origine de cet effet n'est pas très bien connu.
- Ils entrainent aussi un effet d'accoutumance, à savoir qu'il faut sans cesse augmenter les doses pour obtenir le même effet. D'où un effet addictif puissant qui explique que les opioïdes naturels ou synthétiques soient des drogues d'abus.
- Plus rarement, les morphiniques sont utilisés comme antitussifs, avec une bonne efficacité. L'effet antitussif est lié à un effet dépresseur sur le centre de la toux dans le tronc cérébral. La codéine est encore utilisée dans cette indication.
- Outre l'action sur le centre la toux, les opioïdes agissent aussi sur le centre respiratoire, en réduisant le rythme respiratoire. Ce qui explique la dépression respiratoire mortelle observée lors d'overdoses, ou plus rarement comme effet secondaires des opioïdes médicaux.
- Enfin, les opioïdes agissent sur le système nerveux entérique (le système nerveux du système digestif) en réduisant son activité spontanée. Le résultat est un ralentissement de la motricité digestive et une réduction des sécrétions digestives. L'effet final est une constipation chez les sujets sains et une réduction des diarrhées chez le patient diarrhéique. D'ailleurs, certains anti-diarrhéiques sont des opioïdes particuliers, qui ne traversent pas la barrière hémato-encéphalique. Un exemple est l'Immodium/Lopéramide, qui est un opioïde a action périphérique pure.
- Leur effet sur les vomissements est paradoxal. Ils sont émétiques à faibles doses, mais calment les vomissements à des doses assez fortes. Cet effet provient d'une stimulation/dépression du centre du vomissement dans le tronc cérébral, ainsi que de leur effet sur la motricité digestive mentionné juste au-dessus.
| Mu | Delta | Kappa |
|---|---|---|
|
Neurologie/psychiatrie :
Respiration :
Digestion :
| ||
|
| |
| Contraction des pupilles (myosis) | Dilatation des pupilles (mydriase) | Contraction des pupilles (myosis) |
La tolérance aux opioïdes provient d'un phénomène de downregulation, qui entraine une réduction du nombre de récepteurs suite à une exposition chronique de neurotransmetteurs. Les récepteurs, régulièrement saturés par leur neurotransmetteur, quittent la membrane par endocytose avant d'être dégradés par les lysosomes du neurone. De plus, les récepteurs conservés à la surface du neurone se désensibilisent et deviennent de moins en moins sensibles au neurotransmetteur. Ce comportement n'est pas exclusif aux récepteurs opioïdes, mais s'observe chez nombre de récepteurs aux protéines G et sur quelques autres. La conséquence est qu'il faut une dose croissante d’opioïdes pour conserver la m^me activation et compenser la baisse du nombre de récepteurs. Les opioïdes endogènes, vus au chapitre précédent, ont un potentiel addictif très faible car ils sont dégradés très rapidement, en quelques minutes (ce qui n'est pas le cas des autres opioïdes).
Récepteur Mu

Le récepteur mu est très sensible aux enképhalines et aux bêta-endorphines, mais est peu activé par les autres peptides opioïdes. Il en existe trois sous-types, appelés , et , chacun d'entre eux réagissant différemment aux neuropeptides. Les canaux ioniques associés sont des canaux Calcium/potassium pour les récepteurs mu. L'activation du récepteur mu favorise la sortie de Potassium de la cellule, mais empêche l'entrée de Calcium dans le neurone.
L'agoniste synthétique le plus connu pour ce récepteur est de loin la morphine, une puissance anti-douleur. La morphine se lie aux récepteur mu, mais semble avoir peu d'effets sur les autres récepteurs. Une preuve de ce fait est l'étude des souris chez lesquelles on a désactivé le gène qui code ce récepteur mu. Ces souris deviennent totalement insensibles à la morphine, ce qui prouve qu'elle agit sur ces récepteurs et seulement eux. Par contre, les souris sans récepteurs kappa et delta réagissent normalement à la morphine et ses dérivés.
Depuis la découverte de la morphine, diverses molécules dérivées ont étés inventées. Certaines sont devenues des drogues, comme la cocaïne et l’héroïne, mais d'autres sont devenues des traitements médicamenteux assez importants. Toutes ont des effets similaires à la morphine, avec notamment une action anti-douleur, mais aussi des action euphorisante/addictives sans lesquelles certaines ne seraient pas utilisées comme drogue. Ces molécules sont appelées des morphiniques.
Comme les autres opioïdes, la morphine et les autres morphiniques sont analgésiques, euphorisants et addictifs. Ils sont antitussifs et peuvent entrainer une dépression respiratoire à forte doses, sans compter leur effet digestif. Pour ce qui est des effets spécifiques au récepteurs mu, les morphiniques entrainent une contraction musculaire généralisée et une psychose (délires et hallucinations) à fortes doses. L'origine de cet effet délirant/hallucinogène n'est pas très bien connu.
Récepteur Kappa

Le récepteur Kappa est un récepteur métabotrope sensibles aux dynorphines. Son activation a un effet analgésique, mais entraine aussi des perturbations du comportement et de l'humeur.
- L'effet analgésique est similaire à celui des autres récepteurs opioïdes. Les agonistes du récepteur pourraient être utilisés comme anti-douleur, mais les autres effets sont indésirables. Ils ont donc trop de désavantages par rapport aux alternatives thérapeutiques.
- Il est aussi sédatif, contrairement aux autres récepteurs opioïdes.
- Il a un effet hallucinatoire manifeste, qui limite son utilisation en tant qu'anti-douleur.
- Il induit une dépression assez intense, une véritable dysphorie. Cet effet, particulièrement désagréable, limite son usage récréatif ou toxicomaniaque.
Récepteurs cannabinoïdes

Les endocannabinoïdes agissent sur des récepteurs cannabinoïdes spécifiques, que nous étudierons dans le chapitre suivant. Les scientifiques ont identifié deux récepteurs liés aux protéines G, qu'ils ont nommé récepteurs CB1 et CB2. Chaque récepteur est codé par un unique gène, ceux-ci portant les doux noms de CNR1 et CNR2. Le récepteur CB1 est exprimé dans le cerveau et le foie, alors que CB2 est surtout présent dans le système immunitaire. D'ailleurs, les CB2 sont exprimés par les cellules immunitaires cérébrales, la microglie. Mais force est de constater que le récepteurs CB2 n'est pas exprimé par les neurones, sauf en quelques endroits assez localisés où on en trouve de faibles concentrations.
Il est possible que d'autres récepteurs cannabinoïdes existent, mais ils ne sont pas encore connus pour le moment. Les expériences sur des souris laissent en effet penser que le cannabis peut avoir un effet sur des souris où les récepteurs CB1 et CB2 sont inexistants. Grâce à des manipulations génétiques, il est possible de priver des souris de tout gène codant les récepteurs CB1 et CB2. Mais ces souris knock-out réagissent encore au cannabinoïdes, malgré l'absence de tout récepteur identifié. La seule explication est que d'autres récepteurs endo-cannabinoïdes existent dans le cerveau, du moins chez les souris, mais qu'on ne les a pas encore découverts.
C'est grâce à ces récepteurs que le principe actif du cannabis influence le comportement et la perception. On estime qu'une activation régulière de ces récepteurs par le cannabis cause des modifications dans la traduction de l'ADN en protéines, pouvant déclencher des schizophrénies chez des personnes génétiquement prédisposées. Mais si ce mécanisme n'est pas encore validé, l'influence du cannabis sur le déclenchement de troubles schizophréniques est aujourd’hui parfaitement établie.











