Photographie/Physique-chimie/L'état cristallisé
| ||||
|
plan du chapitre en cours
|
navigation rapide
Fabricants et marques de produits et de matériels Personnalités du monde de la photographie Éditeurs de cartes postales photographiques Thèmes ▪
Bibliographie
■ préface - SOMMAIRE COMPLET ■ notions fondamentales et conseils pour les débutants ■ aspects esthétiques, thèmes photographiques ■ références scientifiques ■ photométrie, colorimétrie, optique ■ appareils, objectifs, éclairage, accessoires, entretien ■ procédés chimiques ■ procédés numériques ■ caractéristiques physiques des images, densité, netteté ■ compléments techniques et pratiques ■ photographie et vie sociale, histoire, enseignement,institutions, droit... | |||
État amorphe, état cristallin
[modifier | modifier le wikicode]Dans la nature ou au laboratoire, les corps solides existent aussi bien sous la forme amorphe que sous la forme de cristaux. L'état amorphe correspond à l'absence de toute forme déterminée ou, si l'on préfère, de toute organisation des molécules. Les cristaux, au contraire, présentent spontanément des formes géométriques définies sur lesquelles on peut constater la présence de plans ou faces, d'arêtes ou intersection de faces, de sommets ou intersections d'arêtes. Ainsi, la silice naturelle (quartz ou « cristal de roche ») est généralement cristallisée sous forme de prismes hexagonaux terminés par deux pyramides régulières, tandis que la silice fondue est une substance vitreuse (semblable au verre) et sans organisation définie.
-
Cristaux de quartz
-
Améthyste (quartz)
-
Aragonite
-
Pyrite (l'or du fou)
Formation des cristaux
[modifier | modifier le wikicode]La formation de cristaux peut être obtenue de différentes manières :
- par refroidissement lent d'un liquide fondu ;
- par concentration lente d'une solution ;
- par condensation d'une vapeur ;
- par précipitation d'un composé insoluble.
Certains corps peuvent se présenter sous des formes cristallines différentes : il en est ainsi pour le carbone, qui cristallise sous forme de diamant ou de graphite, le carbonate de calcium, etc.
Systèmes cristallins
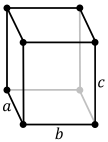
[modifier | modifier le wikicode]Il n'existe en tout et pour tout que sept systèmes cristallins qui, compte tenu de leurs variantes, fournissent 14 formes différentes de réseaux, connues sous le nom de réseaux de Bravais. Le plus simple est le système cubique, selon lequel s'organisent en particulier les cristaux d'halogénures d'argent, mais aussi le sel marin.
Il ne faut pas en déduire que les cristaux ne peuvent se présenter que sous 7 formes différentes, au contraire, leur système est parfois difficile à déterminer car des troncatures peuvent intervenir ; c'est ainsi qu'à partir du cube on peut obtenir, comme nous le verrons, des plaquettes triangulaires ou hexagonales et même des octaèdres.
Plans réticulaires
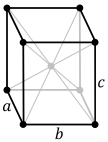
[modifier | modifier le wikicode]Le système cubique simple est celui dans lequel cristallisent de très nombreux composés chimiques, entre autres ceux qui ne sont constitués que de deux sortes d'atomes intervenant en proportions égales sous forme de composés ioniques. C'est le cas, par exemple, du chlorure de sodium ou du bromure d'argent qui constitue l'élément sensible principal des pellicules argentiques.
Le premier dessin ci-dessous est une vue d'artiste d'un réseau cubique, le second représente sous forme de points noirs les ions argent et sous forme de cercles blancs les ions brome du bromure d'argent. Les seconds sont beaucoup plus volumineux que les premiers.
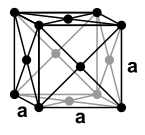
Les plans réticulaires d'un cristal sont ceux dans lesquels les atomes sont dotés d'une structure répétitive, ils correspondent généralement à un maximum de densité atomique. On voit ci-dessous les trois familles de plans réticulaires d'une structure cubique simple, les premiers parallèles aux faces, les seconds passant par les diagonales des faces et les troisièmes perpendiculaires aux diagonales principales du cube. L'organisation des atomes dans ces plans se fait respectivement selon des carrés, des rectangles et des triangles équilatéraux. La rupture des cristaux est d'autant plus facile qu'elle se produit dans la direction des plans de plus forte densité atomique et, dans ces plans eux-mêmes, dans les directions correspondant aux alignements les plus serrés.

Troncatures
[modifier | modifier le wikicode]Il arrive très fréquemment que les cristaux subissent des troncatures qui en changent profondément l'aspect. Le schéma ci-dessous montre comment, à partir d'un système cubique simple dont les sommets se trouvent tronqués perpendiculairement à la diagonale principale, on arrive progressivement à une structure octaédrique. Le grenat, qui cristallise dans le système cubique, montre souvent des troncatures plus ou moins complexes des sommets et des arêtes, comme on le voit ci-dessous. D'autres troncatures peuvent exister dans le système cubique, elles seront envisagées plus loin.
Formes anhydres et formes hydratées
[modifier | modifier le wikicode]De nombreux composés chimiques cristallisent avec une certaine quantité, toujours parfaitement définie, d'eau de constitution. On trouve de nombreux exemples de cristaux hydratés parmi les produits chimiques utilisés en photographie :
sulfite de sodium :
thiosulfate de sodium :
tétraborate de sodium :
carbonate de sodium :
etc.
Certains cristaux sont déliquescents, c'est-à-dire qu'ils ont tendance à absorber la vapeur d'eau atmosphérique, d'autres au contraire sont efflorescents, c'est-à-dire qu'ils tendent à perdre leur eau de constitution. Un exemple bien connu de ce dernier cas est le carbonate de sodium, qu'il faut acheter sous sa forme anhydre, sans quoi il est impossible de savoir avec précision combien d'eau il contient.
On doit toujours tenir compte de l'eau de cristallisation quand on fait une pesée et, dans tous les cas, il est préférerable de choisir des produits qui se présentent sous une forme bien définie et si possible stable.
Exemple :
| anhydre | 162 g (très avide d'eau) | |
| 270 g (stable) |