Photographie/Physique-chimie/Liaisons chimiques
| ||||
|
plan du chapitre en cours
|
navigation rapide
Fabricants et marques de produits et de matériels Personnalités du monde de la photographie Éditeurs de cartes postales photographiques Thèmes ▪
Bibliographie
■ préface - SOMMAIRE COMPLET ■ notions fondamentales et conseils pour les débutants ■ aspects esthétiques, thèmes photographiques ■ références scientifiques ■ photométrie, colorimétrie, optique ■ appareils, objectifs, éclairage, accessoires, entretien ■ procédés chimiques ■ procédés numériques ■ caractéristiques physiques des images, densité, netteté ■ compléments techniques et pratiques ■ photographie et vie sociale, histoire, enseignement,institutions, droit... | |||
Selon la nature des atomes qui s'unissent pour former des molécules, différents types de liaisons peuvent exister, mais nous verrons que dans tous les cas les combinaisons d'atomes se font à l'aide de leurs électrons périphériques ou électrons de valence.
La classification de Mendeleïev fait apparaître des colonnes dans lesquelles se placent des éléments dont les propriétés sont comparables, par exemple, ceux du groupe Ia (métaux alcalins) qui ont un seul électron de valence ou ceux du groupe VIIb (halogènes) qui en ont 7. De même, les éléments de transition et surtout les terres rares dont nous avons évoqué la laborieuse séparation possèdent le même nombre d'électrons périphériques.
À l'exception de l'hélium qui en compte deux, les gaz inertes comptent 8 électrons de valence. Cette structure est particulièrement stable et pour comprendre le processus des liaisons chimiques il faut retenir que dans la grande majorité des cas, les différents atomes se combinent de telle manière que leur configuration électronique externe se rapproche de celle du gaz inerte le plus proche.
Selon la manière dont se font les arrangements électroniques, on a coutume de distinguer plusieurs grands types de liaisons :
Liaison ionique
[modifier | modifier le wikicode]Les ions sont des atomes ou des groupes d'atomes chargés électriquement à la suite du gain ou de la perte d'un ou plusieurs électrons. Comme les électrons sont chargés négativement, le gain d'un électron correspond à l'apparition d'une charge négative et la perte d'un électron à l'apparition d'une charge positive.
Les atomes qui possèdent un, deux ou trois électrons périphériques tendent à les perdre pour se transformer en ions positifs ou cations. Le potassium K et le calcium Ca donnent ainsi les ions K+ et Ca2+ dont la configuration électronique est celle de l'argon. De la même façon, les halogènes qui possèdent 7 électrons périphériques tendent à en gagner un. Le chlore Cl donne facilement l'ion négatif ou anion Cl-. Les corps tels que le chlorure de potassium KCl ou le chlorure de calcium CaCl2 sont ainsi formés d'ions retenus par des forces électrostatiques. Il y a échange d'un électron pour KCl et de deux électrons pour CaCl2.
Les figures ci-dessous représentent les atomes de sodium et de chlore (chlorine en anglais). Le premier possède un seul électron sur sa couche périphérique et tend à le perdre pour devenir un ion Na+, tandis que le second, qui en possède 7, tend à en gagner un pour devenir un ion Cl-. On conçoit bien que ces deux atomes sont en quelque sorte « faits pour s'entendre », leur combinaison donnera le chlorure de sodium NaCl plus connu sous le nom de sel de cuisine.
-
Atome de sodium
-
atome de chlore
Les liaisons ioniques se forment entre des ions de charges opposées qui s´attirent et restent près l'un de l'autre. Lorsque beaucoup d'ions sont présents, ils forment de grands réseaux cristallins ordonnés où chaque ion est entouré d'autres ions de charge opposée.
Liaison covalente
[modifier | modifier le wikicode]Ici les électrons ne sont plus échangés mais mis en commun. C'est le cas pour les gaz diatomiques Cl2, 02 et N2 dont les atomes sont liés respectivement par 1, 2 ou 3 paires d'électrons :
-
Formation de la molécule d'oxygène
On note les molécules correspondantes Cl-Cl, 0=0, N≡N et l'on parle de liaisons simples, doubles ou triples. De telles liaisons sont très courantes en chimie organique (chimie des dérivés du carbone).
Liaison dative ou de coordinence
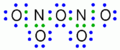
[modifier | modifier le wikicode]Cette fois, les électrons ne sont ni échangés, ni mis en commun, mais cédés par paires de l'un des atomes à l'autre. Chacun des deux atomes d'azote de l'oxyde N203, par exemple, peut encore fixer un atome d'oxygène pour donner N205.
-
Oxyde d'azote N203
-
Oxyde d'azote N205
Les formules développées peuvent s'écrire
O=N-O-N=O + 02 → O=N-O-N=O
↓ ↓
0 0
Notion de valence
[modifier | modifier le wikicode]Le nombre d'électrons donnés, pris, ou de paires d'électrons mises en commun par un élément dans une liaison est caractéristique de la valence de cet élément. La plupart des éléments possèdent un degré de valence principal et des degrés de valence secondaires. Le fait que les atomes, à partir de la seconde période de la classification, tendent à établir des liaisons telles que leur couche électronique possède 8 électrons fait que l'on évoque parfois la règle de l'octet de valence.